Цвет пигментов определяется совокупой явлений рассеяния и поглощения света их частичками. В случае селективного поглощения света частичками пигмента на каком-либо участке видимой области диапазона электрических колебаний растерянный свет, попадающий в органы зрения человека, вызывает чувства цвета. Видимая область диапазона приходится на интервал частот электрических колебаний от 4,0*1014 до 7,9*1014с-1 (длины волн 760—380 нм). Объект, умеренно рассеивающий или стопроцентно либо отчасти всасывающий свет во всей видимой области диапазона, является тусклым (белоснежным, черным либо сероватым). Если вещество поглощает какую-то часть диапазона, то оно будет окрашено в цвет, дополнительный к поглощенному. Дополнительными именуют цвета, способные при сложении давать белоснежный цвет. Ниже показана зависимость цвета вещества от цвета и длины волны поглощенного света:
| Цвет поглощенного света | Длина волны погло щенного света, нм | Цвет вещества |
| Фиолетовый | 400—435 | Желто-зеленый |
| Голубий | 435—490 | Желтоватый |
| Голубовато-зеленый | 490—510 | Красноватый |
| Зеленоватый | 510—560 | Пурпуровый |
| Желто-зеленый | 560—580 | Фиолетовый |
| Желтоватый | 580—595 | Голубий |
| Оранжевый | 595—610 | Зеленовато-голубой |
| Красноватый | 610—750 | Сине-зеленый |
Как понятно, свет определенной длины волны (определенной частоты либо, как следует, определенной энергии) поглощается в этом случае, если его энергия соответствует энергии перехода электрона в более высочайшее энергетическое состояние. Частота электрических колебаний, которые могут вызвать переход электрона с более низкого энергетического уровня на более высочайший, определяется вторым квантовым уравнением Бора, так именуемым частотным уравнением:
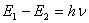
где Е1— энергия атома в начальном состоянии; Е2 — энергия атома в возбужденном состоянии; h — неизменная Планка; n — частота.
В любом случае, для того чтоб соединение было окрашенным, нужно наличие электронов в атоме, которые могут быть подняты на более высочайший уровень таким макаром, чтоб частота n из второго квантового уравнения Бора соответствовала области видимого света. Электрические переходы, удовлетворяющие этому условию, могут иметь разный характер.

ПЗ-Переход. Цвет многих кристаллических соединений обоснован электрическими переходами с молекулярных орбиталей, локализованных в большей степени на лигандах, на орбитали, локализованные на атоме металла. Таковой переход носит заглавие перехода с переносом заряда от лиганда на металл (ПЗ-переход). Этот переход более энергетически вероятен, если кристаллическая решетка состоит из очень поляризующих катионов и очень поляризующихся анионов. Для этого необходимо, чтоб катионы имели маленький ионный радиус и высшую валентность, а анионы — большой ионный радиус и низкую валентность. Повышение поляризуемости аниона и поляризующей возможности катиона приводит к понижению энергии, нужной для воплощения перехода, т. е. сдвигает максимум поглощения света в длинноволновую область (батохромный эффект). Так, к примеру, происходит углубление расцветки при переходе от РbО к РbO2, вызванное уменьшением ионного радиуса свинца от 1,26 до 0,76 и возрастанием степени окисления свинца. Такое же явление наблюдается при переходе от Fе(ОН)2 к Fе(ОН)3 (ионные радиусы железа 0,8 и 0,67 соответственно). ПЗ-Переходом обоснована расцветка таких важных групп хроматических пигментов, как крона (пигменты, в состав которых заходит ион CrO42 — ) и железооксидные пигменты.
d?d — Переход. Так как энергия видимого света сравнимо невелика, то, как следует, нужным условием окрашенности соединения является наличие так именуемых рыхлосвязанных электронов. Обычно, легче возбуждаются электроны в ионах с незавершенной электрической оболочкой. Так, практически все соединения частей побочных подгрупп повторяющейся системы являются окрашенными. Другими словами, окрашенными обычно являются соединения частей с незавершенными d-орбиталями.
Каждый электрический слой с основным квантовым числом 3 имеет набор из 5 d-орбиталей, отличающихся пространственным расположением. Если катион d-элемента не находится в окружении заряженных групп, то все 5 орбиталей энергетически эквиваленты. Таким макаром, d-электрон может с схожей вероятностью находиться на хоть какой из 5 орбиталей. Но, если катион находится под воздействием электростатического поля отрицательных зарядов, окружающих его и расположенных в верхушках октаэдра, тетраэдра либо занимающих в пространстве другие фиксированные положения, d-орбитали энергетически не эквиваленты. Более энергетически прибыльными будут орбитали, очень удаленные от отрицательных зарядов, т. е. будет иметь место так называемое расщепление d-орбиталей в электростатическом кристаллическом поле на уровни разной энергии. Переход электрона с 1-го уровня на другой вследствие расщепления d-орбиталей в электростатическом кристаллическом поле носит заглавие d?d — перехода.
d?d — Переходом обоснована зеленоватая расцветка оксида хрома (III) и изумрудной зелени, где ион Сг3+ имеет строение наружного электрического слоя 3S23р63d3 и его основное состояние расщепляется в поле лигандов на три уровня.
Переход электрона с катиона более низкой валентности на катион более высочайшей валентности. Пигменты, в состав которых входят металлы в различных валентных состояниях, всегда активно покрашены. К таким пигментам относятся свинцовый сурик Рb3О4, являющийся свинцовой солью ортосвинцовой кислоты, темный железооксидный пигмент Fе3О4, кристаллическая решетка которого представляет собой кубическую плотную упаковку ионов кислорода, в пустотах которой распределены ионы Fе2+ и Fе3+. Расцветка этих соединений обоснована переходом электрона с иона более низкой валентности на ион более высочайшей валентности.
Электрические переходы, вызванные недостатками кристаллической структуры. Цвет кристаллического вещества может определяться наличием в нем точечных изъянов, которые служат предпосылкой возникновения дополнительных энергетических уровней; надлежащие им электрические переходы могут происходить под действием электрического излучения видимой части диапазона. Центром расцветки может быть анионная вакансия, которая, действуя как положительный заряд, захватывает свободный электрон, поставляемый любым примесным атомом; таковой центр расцветки именуют F-центром. Центром расцветки может являться совокупа катионной вакансии и дырки; таковой центр именуется V-центром. Могут быть и поболее сложные центры, состоящие из 2-ух анионных вакансий и электрона либо совокупы F-центра, катионной и анионной вакансий.
Наличием центров расцветки определяется цвет ультрамарина, кристаллическая решетка которого представляет собой решетку алюмосиликата. Эта решетка состоит из общих для 2-ух тетраэдров атомов кислорода и чередующихся атомов кремния и алюминия. Вследствие наименьшей валентности алюминия алюмосиликатный каркас заряжен негативно, катионы натрия, уравновешивающие отрицательный заряд каркаса, умеренно распределены снутри него. Не считая катионов снутри каркаса содержатся ионы либо радикалы серы. Наличие серы в пустотах кристаллической решетки ультрамарина приводит к возникновению широкой полосы поглощения в длинноволновой области видимой части диапазона.
Электрические переходы, обусловливающие цвет органических соединений. В согласовании с теорией молекулярных орбиталей, образование s — и p-связей в молекуле в общем случае приводит к реализации набора молекулярных орбиталей, характеризующихся разным рассредотачиванием электрических плотностей меж ядрами атомов. Орбитали с наибольшей электрической плотностью меж атомами владеют наименьшей энергией, ежели орбитали с малой электрической плотностью. Орбитали с наименьшей энергией именуют связывающими, орбиталм с большей энергией — разрыхляющими. Если в молекуле имеются атомы со свободными электрическими нарами, не принимающими роли в образовании связей, то они находятся на несвязывающей орбитали (n). Энерго уровни соответственных орбиталей растут в последующем порядке:
s Поглощение света молекулой вызывает переход электронов в ней на более высочайший энергетический уровень. Вещество будет всасывать свет в видимой части диапазона, если вероятны переходы электрона под действием электрического излучения соответственной энергии. Переход s ? s*, более соответствующий для насыщенных углеводородов, совершается с поглощением энергии, соответственной далекой УФ-области диапазона. p— p*-переходы, соответствующие для ненасыщенных органических соединений, требуют наименьших энергий. Но в случае изолированных двойных связей поглощение света происходит в УФ-области, и только при наличии сопряжения увеличение энергии p-уровня может привести к такому понижению энергии этого перехода, что он будет происходить под действием света видимой части диапазона. Удлинение системы сопряжения вызывает батохромный эффект. В гетероорганических соединениях неподеленные электроны азота, кислорода, серы способны к n — p* и n — s* переходам, требующим сравнимо малых энергий. По этой причине большая часть гетероорганических соединений поглощают свет в видимой и ближней УФ-области. Присоединение к системе сопряжения поляризующих заместителей, смещающих p-электроны в невозбужденном состоянии по цепи сопряжения, приводит к понижению энергии p— p* перехода и вызывает батохромный эффект. Введение в молекулу таких заместителей не считая смещения полосы поглощения в длинноволновую область вызывает также и увеличение максимума абсорбции света (гиперхромный эффект). На цвет органических соединений влияют и пространственные причины. Так, искажение формы молекулы (углов меж направлениями связей) увеличивает энергетический уровень молекулы в главном состоянии, понижает энергию перехода в возбужденное состояние и вызывает тем батохромный эффект. Но, если вероятен поворот одной части молекулы относительно другой, и введение какого-нибудь заместителя нарушает плоскостную структуру молекулы красителя, то это приводит к гипохромному эффекту из-за разобщения отдельных участков цепи сопряжения. Итак, цвет вещества находится в зависимости от положения полосы поглощения в видимой части диапазона. Но на цвет пигмента в большой степени оказывают влияние форма и размер частиц, потому что суммарное цветовое чувство определяется не только лишь диапазоном поглощения, да и нравом рассеяния света частичками пигмента. Так, повышение размера частиц свинцового оранжевого и красноватого свинцово-молибдатного кронов приводит к смещению максимума отражательной возможности пигмента в длинноволновую область, т. е. к усилению красноватого колера. Рост кристаллов при синтезе желтоватого железооксидного пигмента ведет к сильному потемнению продукта. Варьируя размеры частиц красноватого железооксидного пигмента, можно получить целую палитру цветов. Огромное воздействие на цвет пигмента оказывает кристаллическая структура.
 12 января, 2015
12 января, 2015  Pokraskin
Pokraskin  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: 