Парциальная молярная характеристика раствора Х2° представляет собой сумму вкладов различной физической природы. Составляющие этой суммы удобнее проиллюстрировать на примере конкретной характеристики, например сжимаемости. Парциальная молярная сжимаемость К20 какого-либо соединения может быть представлена в виде:
Ж°2=/См+А/С, + Ки 2, (3.1)
Здесь Км — собственная сжимаемость молекулы растворенного вещества (для низкомолекулярных соединений Кіл определяется сжимаемостью ковалентных связей и вандерваальсо — вых радиусов составляющих ее атомов; эта сжимаемость мала и обычно ею пренебрегают [145—147, 164]); AKt— изменение сжимаемости воды в гидратной оболочке; /Сі,2 — сжимаемость «контактов» между молекулой растворенного вещества и окружающими молекулами воды. Смысл вклада Кі,2 можно пояснить на примере гидрофобных молекул, не образующих водородных связей с молекулами воды. В водном растворе гидрофобная молекула находится в полости, образованной сеткой водородно-связанных молекул воды. Так организованы клат — ратные гидраты [165], такие структуры получаются в машинных экспериментах, выполненных методами Монте-Карло и молекулярной динамики [166, 167]. Объем полости, занимаемой молекулой растворенного вещества, должен превышать ее ван — дерваальсов объем вследствие теплового движения молекул. В результате полость приобретает дополнительную сжимаемость, определяющую величину /Сі,2, которая, как показывают оценки, может быть весьма существенной. В случае полярных молекул, образующих водородные связи с молекулами воды, /Сі, г определяется свойствами этих связей. Феноменологически величину /Сі,2 можно условно отнести к свойствам воды в гидратной оболочке и не выделять в виде отдельного члена. Однако учет такой составляющей либо в виде отдельного члена, либо в составе А/Сі является важным, в особенности при сопоставлении термодинамических данных с результатами спектральных измерений.
Таким образом, парциальная молярная характеристика раствора может быть представлена в виде суммы
Х°2=Х„+ДХ1 + Х1,2, (3.2)
Члены которой имеют тот же смысл, что и в уравнении для сжимаемости (3.1).
Количественная оценка вклада Х1>2 в термодинамические величины затруднительна, поэтому в дальнейшем изложении мы относим её условно к свойствам гидратной воды и будем оперировать разностью
AXh=X°2~X. A, (3.3)
Называя ее «избыточной величиной». В случае теплоемкости под (Ср)м будем подразумевать теплоемкость в газообразном состоянии, отражающую вклад внутренних степеней свободы [162, 168]. В случае парциального объема величина Ум принимается равной вандерваальсову объему, а в случае парциальной сжимаемости /См принимается равной нулю, как обсуждалось выше. Введенные таким способом избыточные величины отличаются от термодинамических функций смешения, однако они удобны для эмпирического анализа гидратации, так как в основном определяются структурными изменениями воды.
При переходе от получаемых в эксперименте характеристик раствора Х2° к характеристикам гидратных оболочек важно знать зависимость размеров гидратной оболочки от температуры и давления.
Необходимо знать, чем определяется изменение величины АХи при_ изменении температуры — изменением физических свойств Хі, н воды в гидратной оболочке или изменением числа молекул воды в оболочке fth? Решение этого вопроса упрощается благодаря установленному выше факту локальности гидратной оболочки. В самом деле, локальность возмущения структуры воды означает, что гидратной оболочке можно приписать естественную границу — первый (или второй) минимум функции радиального распределения. Отсюда следует очевидное утверждение, что значение дпи/пидТ не превышает коэффициента теплового расширения, который для жидкостей составляет около 10~3. Этой малой величиной при анализе температурной зависимости Х2° можно пренебречь. Подобные же соображения можно привести в пользу слабой зависимости пи от давления.
Чистая вода обладает рядом аномалий, отличающих ее от большинства других жидкостей. К таким аномалиям относятся немонотонные зависимости сжимаемости, теплоемкости, плотности. Немонотонность вызвана необычно большими вкладами структурной релаксации воды в термодинамические характеристики, обусловленными лабильностью сети водородных связей по отношению к изменению температуры или давления. Сжимаемость воды К, как и любой другой жидкости, определяется выражением
K=K.Str + Kc°,
Где Kstr — структурная сжимаемость, обусловленная изменением структуры воды при изменении давления; К<*> — сжимаемость на временах, меньших времен структурной релаксации воды («Ю-12 с) [169].
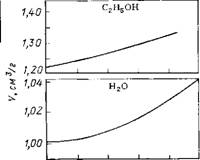
Аналогичные выражения справедливы для теплоемкости и коэффициента теплового расширения. Структурные величины обычно сильно зависят от температуры. При комнатных (и более низких) температурах структурные вклады аномально велики. Так, в случае сжимаемости KstrlK°E—,B [170], в то время как для большинства других жидкостей это отношение меньше единицы [171]. В конечном счете все аномалии воды обусловлены лабильностью структуры воды в отношении воздействия теплом или давлением. В ряду наиболее характерных аномалий воды — резко нелинейная температурная зависимость объема, сжимаемости и теплоемкости с положительной второй производной. Это проиллюстрировано на рис. 3.7 на примере объема и сжимаемости воды и, для сравнения, сжимаемости «нормальных» жидкостей — спиртов и ртути [172—175].
Значительная доля поверхностных гидрофильных атомных групп биополимеров представлена заряженными группами. Их взаимодействие с водой и ионными компонентами растворителя во многом определяет структуру и стабильность нуклеиновых кислот и белков и термодинамические свойства их растворов. Хорошими моделями заряженных атомных групп биополимеров являются одно-одно-валентные (1-1) электролиты и цвиттерио — ны аминокислот.
Парциальные молярные характеристики 1-1-электролитов характеризуются двумя особенностями: 1) большими отрицательными значениями парциальных молярных теплоемкостей, сжимаемостей и объемов (за вычетом собственного объема иона) (рис. 3.8) [176] и 2) наличием экстремума на темпера
турных зависимостях этих величин [149, 177]. То же относится и к цвиттерионам аминокислот [161, 178—180]. Первая особенность обусловлена сильным электрострикционным сжатием воды в электростатическом поле иона [144, 181] и, как следствие, уменьшением структурных составляющих сжимаемости и теплоемкости. Для обсуждения второй особенности удобно переписать соотношение (3.2) в виде
Х°2=~Хс — ПнХи (3.4)
Где Хс — объем, сжимаемость или теплоемкость гидратного комплекса, состоящего из молекулы растворенного вещества и окружающей его гидратной оболочки; — молярный объем нли другая соответствующая характеристика чнстой воды; Nh — число молекул в гидратной оболочке.
|
О 20 40 ■ 60 80 100 |
|
І,0 С |
|
Рис. 3.7. Температурная зависимость коэффициента сжимаемости (Л) и объема (Б) воды [174, 175], ртути [172], метанола и этанола [172, 173] |
|
|
|
Нго |
||
|
_ |
Рту’ |
|
|
— |
1 I |
|
|
— |
Hg |
|
|
1 —-— 1 |
1 ‘ |
|
G 50 Т 43 |
|
"=5. |
|
45 44 4,0 3,8 |
|
О 20 4 0 60 80 100 |
Немонотонность температурных зависимостей Х2(Т) для электролитов является следствием того, что функции Xi (Т)
|
70 T,°С Рис. 3.8. Температурная зависимость парциального объема (Л) и парциальной сжимаемости (5) водных растворов: / —NaCI; Г —сахароза. По данным работ [149. 177, 185] |
Чистой воды сильно нелинейны, а функции Хс(Т) близки к линейным. Об этом свидетельствуют три обстоятельства. Во-первых, для органических растворителей, характеризующихся линейной зависимостью Vi(T), зависимость V2°(Т) электролитов также линейна [182]. Во-вторых, если предположить, что температурная зависимость Хс близка к линейной, тоі можно рассчитать величину tih из соотношения
|
|
(3.5>
Для электролитов КС1, NaCl, KBr, KI значения Пн, приходящиеся на пару катион-анион, рассчитанные по V20 и К20, получаются равными 18—22 [149]. Это примерно соответствует числу молекул воды, которые размещаются в пределах слоя в 0,4 нм вокруг иона (для пары ионов), что хорошо согласуется с результатами, полученными методом «молекулярного щупа». Такая же картина наблюдается и в случае цвиттерио — нов аминокислот [161]. В-третьих, рассчитанные этим методом значения пн для NaCl на основании независимых данных о парциальном объеме и парциальной сжимаемости совпадают.
В сильном электростатическом поле иона структура воды значительно меняется, что приводит к потере ею аномальных свойств и, как следствие, к линеаризации температурных зависимостей сжимаемости и объема.
Как видно из проведенного обсуждения, абсолютные значения парциальных молярных величин — сжимаемости, теплоемкости и объема ионов — и их температурные зависимости свидетельствуют о том, что вода в гидратной оболочке утрачивает аномальные свойства, присущие ей в объемной фазе.
Большая часть полярных атомных групп на поверхности белков и нуклеиновых кислот расположена близко друг к другу, так что молекула воды в гидратной оболочке может связываться с поверхностью двумя водородными связями [138— 140]. Поэтому хорошей моделью для изучения свойств воды полярной поверхности биополимеров могут служить полифункциональные низкомолекулярные соединения со сближенными полярными группами, такие, например, как сахара, аминокислоты и др.
По характеру воздействия на термодинамические свойства воды сближенные полярные атомные группы сходны с заряженными, только выражено это воздействие в меньшей степени. Вклады в AKh и ACp. h отрицательны, отрицательна также вторая производная парциальной сжимаемости [149, 161, 168, 183—185]. Следовательно, вода в гидратной оболочке имеет пониженную сжимаемость и теплоемкость и более линейную, чем у чистой воды, температурную зависимость сжимаемости.
Это можно объяснить тем, что полифункциональная молекула является как бы жесткой «матрицей», которая благодаря наличию многих центров связывания стабилизирует структуру окружающей воды в некой заданной конфигурации. В результате уменьшается релаксационная составляющая сжимаемости и теплоемкости. Температурная зависимость сжимаемости воды приближается к линейной, что свойственно нормальной жидкости. Заметим, что определению «стабилизация структуры воды» разные авторы придают различный смысл. Здесь под ним понимается сохранение геометрии водородных связей и уменьшение разнообразия возможных конфигураций.
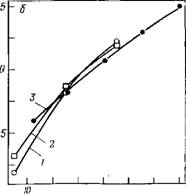
На рис. 3.8 показана температурная зависимость парциальной сжимаемости сахарозы как пример поведения молекул, содержащих большое число сближенных друг с другом атомных групп [185]. Одиночные полярные группы качественно отличаются от сближенных групп по действию на свойства воды. При этом под одиночной понимается атомная группа, удаленная от других полярных атомных групп на расстояние не менее четырех СНг-групп между ними. Термодинамические эффекты сближения полярных групп известны давно (см., например, [151, 152, 168]). Они учитываются при аддитивных расчетах парциального объема, теплоемкости, свободной энергии и энтальпии гидратации [168]. Наиболее ярко эти различия проявляются при изучении сжимаемости. В работе [161] проведен аддитивный анализ парциальной адиабатической сжимаемости аминокислот и спиртов[1] и показано, что вклад в сжимаемость от одиночной полярной группы, во-первых, положителен и, во-вторых, его температурная зависимость имеет отрицательную первую и положительную вторую производную, — т. е. все названные величины противоположны по знаку тем же величинам для сближенных атомных групп (рис. 3.9).
Такое отличие одиночных полярных групп можно понять, предположив, что молекула воды, связанная с жесткой «матрицей» только одной водородной связью, мало отличается от молекулы чистой воды по своей способности участвовать в различных конфигурациях сетки водородных связей. Вклад таких молекул не должен сильно изменить термодинамические свойства воды. Не исключено и некоторое увеличение релаксационной составляющей.
Интерес к гидратации неполярных соединений связан, прежде всего, с особой ролью, которую играют гидрофобные эффекты в организации биологических молекулярных и надмолеку-
Рис. 3.9. Температурные зависимости вклада гидроксильной группы в парциальную сжимаемость при различной удаленности от других гидрофильных групп [161].
|
§ |
|
20 30 W 50 ■ ВО T, С |
Удаление на расстояние большее, чем в три атома углерода от других групп: / — HO(CH2hOH; 2 — НСМСНгЬОН. Вблизи других групп: 3 — треонин; 4 — серии; 5 — НО(СН2)2ОН
Лярных структур. Кроме того,, неполярные молекулы, будучи наиболее простыми по типу межмолекулярного взаимодействия, демонстрируют в водных растворах необычные зависимости термодинамических. Ід То Зо W 50 во T°C свойств. Понимание* физической природы этих особенностей необходимо для формирования общих представлений: о структуре водных растворов [162, 186].
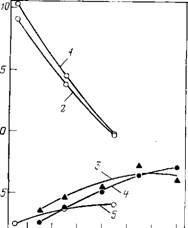
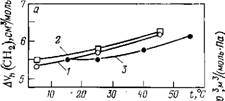
Избыточный объем СН2-группы положителен, слабо зависит от температуры и нелинейно растет с ее повышением (рис. 3.10, а) [151, 161, 183, 184]. Последнее обстоятельство’ указывает на усиление «аномальности» свойств воды в результате (как считали Хепплер [183] и Нил и Горинг [184]) «структурообразующего» действия алифатического радикала. Однако этому противоречит характер температурной зависимости парциальной сжимаемости (рис. 3.10,6): наличие области температур с отрицательными значениями АКн и отрицательная вторая производная температурной зависимости указывают на уменьшение релаксационной составляющей сжимае-
|
Рис. 3.10. Температурная зависимость ^ избыточного объема (а) и избыточ- Jl Ной сжимаемости (б) СН2-группы в ^ Гомологических рядах: 1 — алканолов н 2 — а, со-диолов [151, 152]; 3 — нормальных алифатических аминокислот [1611 |
Рис. 3.11. Температурная зависимость избыточной теплоемкости СН2-группы в солях жирных кислот. Вычислено по данным [191]
Мости, на «нормализацию» воды в гидратной оболочке. На рис. 3.11 приведены данные только по адиабатической парциальной сжимаемости. Как следует из экспериментальных данных Хейланда [188], парциальные изотермическая и адиабатическая сжимаемости СНг-группы практически равны [161].
Указанное выше противоречие может быть объяснено с использованием формализма простейшей качественной модели жидкой воды — модели двух состояний (см., например, [187]). В работе [161] показано, что при неглубоком смещении равновесия в сторону состояния с пониженной плотностью и пониженной энтальпией есть такая область «концентрации» двух структур, в пределах которой увеличение второй производной объема воды соответствует уменьшению второй производной сжимаемости до нуля и меньше. На структурном уровне понижению энтальпии соответствует упрочнение водородной связи, что согласуется со спектроскопическими данными [189] и результатами машинных расчетов [166, 167].
Если отнести вклад Хі, г в парциальную сжимаемость к свойствам гидратной оболочки и принять п/, = 4 (число ближайших соседей), то, как показывает расчет сжимаемости воды в гидратной оболочке, она мало отличается от сжимаемости чистой воды [161, 190]. Крутой рост парциальной сжимаемости с повышением температуры объясняется увеличением амплитуды тепловых движений молекул, или, иначе говоря, расширением полости вокруг молекулы растворенного вещества.
|
Ео с, с |
Положительное значение избыточной теплоемкости при температурах ниже 55 °С (см. рис. 3.11) означает повышенную теплоемкость воды в гидратной оболочке по сравнению с чистой водой. Это согласуется с представлением о том, что вблизи алифатических групп повышена доля сильных водородных связей, в результате чего повышается релаксационная составляющая теплоемкости воды. С ростом температуры релаксационная составляющая убывает. Затруднения возникают, однако, при попытке объяснить с этих же позиций переход избыточной теплоемкости в область отрицательных значений при температурах выше 55 °С. Остается пока неясным, почему при высокой температуре теплоемкость гидратной оболочки становится меньше, чем у. чистой воды.
Биополимеры. Существенная, при рассмотрении проблемы гидратации, особенность биополимеров состоит в наличии большой и сложной по химическому составу молекулярной поверхности. Возникает вопрос: не может ли такая поверхность в отличие от малых молекул оказывать на воду усиленное воздействие вследствие кооперативных эффектов? Один из путей решения вопроса состоит в анализе аддитивности термодинамических гидратационных эффектов по атомному составу гидра — тируемой поверхности. Кооперативность проявилась бы в усилении гидратационного эффекта по сравнению с суммой вкладов поверхностных атомных групп, который подсчитывали на основании анализа низкомолекулярных соединений. _
Парциальную термодинамическую характеристику Х2 полимера можно представить в виде суммы
Х2=Хл+Хге1-(3.6)
Здесь собственный вклад молекулы Xм в случае полностью развернутого полимера может быть принят равным сумме вкладов атомных групп или мономеров. В случае компактных макромолекул (глобулярные белки) величина Хм. возрастает, поскольку значительная часть атомных групп скрыта от растворителя и участвует во внутримолекулярных взаимодействиях. Вклад релаксации от свободных движений звеньев полимера Xrei может быть сравнительно малым в случае компактных макромолекул и заметно возрастать в развернутых полимерах. Эти два вклада необходимо учитывать для правильной оценки гидратационного эффекта ДХн полимера.
Затруднения, связанные с необходимостью проводить разделение вкладов, — одна из главных причин слабой изученности аддитивности гидратационных эффектов биополимеров. Наиболее исследована аддитивность парциального объема белков [178, 192]. Для них экспериментальные парциальные объемы совпадают с результатами аддитивных расчетов с точностью ~2%. Однако в расчетах не учитываются различия в состоянии аминокислотных остатков, экспонированных в растворитель (т. е. гидратированных) и погруженных внутрь молекулы. Указанная точность совпадения при столь упрощенной схеме расчета является, на наш взгляд, в некотором смысле случайной. Совпадение в значительной мере является результатом компенсации двух противоположных гидратационных эффектов: увеличения объема воды около неполярных атомных групп и уменьшения объема около полярных атомных групп, образующих водородную связь с молекулами воды. Следовательно, парциальный объем не может быть «инструментом» анализа аддитивности гидратационных термодинамичесих эффектов биополимеров.
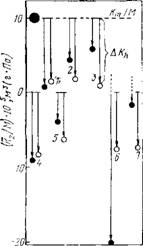
Рис. 3.12. Шкала парциальных удельных сжи-
Маемостей белков и полипептидов. По данным работ [161, 196]. Горизонтальной пунктирной линией вверху обозначена собственная удельная сжимаемость глобулы (средняя по всем глобулярным белкам). • — эксперимент, О — аддитивный расчет. Стрелки, на — правленные вниз, означают величину гидратационного вклада в Kt! M: для глобулярных белков она отсчитыва — ■ется от значения сжимаемости глобулы, для полностью развернутых цепей — от нуля, поскольку в этом случае собственная сжимаемость молекулы отражает ничтожно малую сжимаемость вандер-ваальсовых объемов аминокислотных остатков. } — рибонуклеаза; 2— лизоцнм; <і — миоглобин; 4 — полиглутаминовая кислота; 5 — поли — С,1.-аланин; 6 — коллаген нативный [161, 202]; 7 — коллаген деструктурированный (желатина) [200]
Теплоемкость биополимеров — характеристика вовсе не исследованная в отношении аддитивности гидратационных эффектов поверхности, по-видимому, из — за осложнений, с которыми исследователи сталкиваются при попытках аддитивного анализа — даже низкомолекулярных соединений [162, 193], не говоря уже об обсуждавшихся выше дополнительных трудностях, связанных с биополимерами.
Единственной характеристикой, использованной для систематического анализа аддитивности гидратационных эффектов соединений (от низкомолекулярных до биополимеров), является адиабатическая сжимаемость [142, 149, 161, 194—197]. Приведем основные результаты этих исследований, начиная с полимера небиологической природы — полиэтиленгликоля, как самого простого по структуре.
Полиэтиленгликоль — наиболее полно развернутый (доступный растворителю) полимер в водном растворе. В работе [197] исследован ряд от моно — до тетраэтиленгликоля и полиэтилен — гликоль и показано, что парциальный объем и парциальная адиабатическая сжимаемость с хорошей точностью описываются суммой вкладов мономеров, которые определены по данным для низкомолекулярных олигомеров. Аддитивна также и теплоемкость полиэтиленгликоля [198]. Следовательно, специфических полимерных эффектов здесь нет.
|
|
Развернутые синтетические полипептиды. Аддитивность их парциальной сжимаемости анализировалась в работах [161, 196]. При этом показано, что эксперимент дает либо совпадающие по абсолютной величине, либо заниженные (но не более Чем на 30%) значения гидратационного эффекта относительно аддитивного расчета. Это иллюстрирует рис. 3.12, на котором приведена шкала удельных парциальных сжимаемостей развернутых полипептидов и белков при 25 °С [191]. Аминокислотные остатки и полипептиды попадают в область отрицательных
значений из-за того, что при £<30°С все типы атомных групп влияют на сжимаемость воды в гидратной оболочке таким образом, что она понижается [161, 190]. Следовательно, гидратаци — онный эффект развернутого полипептида не превышает гидра — тационный эффект низкомолекулярных компонентов полимера.
Глобулярные белки. Систематические исследования парциальной сжимаемости глобулярных белков проводились в ряде работ [161, 190, 199—201], но только в работе [161] выполнен анализ аддитивности гидратационного эффекта поверхности нескольких белков (рибонуклеазы, лизоцима и миоглобина). Экспериментальные значения приведены на шкале удельных парциальных сжимаемостей (рис. 3.12). Это положительные величины, так как отрицательный гидратационный член АКп С избытком компенсируется большим положительным вкладом собственной сжимаемости Км (релаксационный вклад Кгеї не учитывается в анализе, так как он мал, как было, показано в работе [200]). Величина Кт! М определена в работах [161, 190] как средняя для всех глобулярных белков, и ее значение 10~6 м3/(г-Па) приведено на рис. 3.12. Отклонение экспериментального значения парциальной сжимаемости белка от величины Км. характеризует гидратационный вклад, который можно сравнивать с величиной, полученной на основании аддитивных расчетов.
Поверхность глобулярных белков представлена нерегулярно расположенными группами близких друг к другу полярных атомов, между которыми находятся небольшие «островки» неполярной поверхности [138]. Поэтому в аддитивных расчетах в работе [161] использовались значения вкладов, характерных для сближенных полярных групп. Вклады неполярных атомных групп учитывались пропорционально их доступной поверхности. Вклады заряженных групп учитывались без каких-либо поправок. На рис. 3.12 приведены вычисленные значения А/С-і в виде отрезков, отложенных вниз от Км. Видно, что экспериментальные значения гидратационных эффектов по’ абсолютной величине в среднем на 30% ниже вычисленных. Следовательно, на поверхности глобулярного белка нет кооперативных эффектов, усиливающих гидратационный эффект сжимаемости по сравнению с низкомолекулярными соединениями.
Фибриллярные белки характеризуются регулярным расположением полярных групп вдоль длинной жесткой полимерной цепи. Для одного из наиболее характерных фибриллярных белков— коллагена — в литературе есть данные по скорости ультразвука в растворе [202]; по этим данным в работе [161] вычислена парциальная адиабатическая сжимаемость, значение которой аномально низко. На шкале сжимаемостей (см. рис. 3.12) приведен результат аддитивного расчета К2 полностью развернутой цепи коллагена. Это значение можно счи-
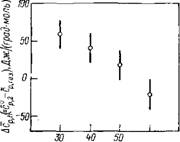
Рис. 3.13. Значение ДЛад для различных биополимеров [,149]:
Поли (А) — одиоиитевая спираль; поли (У) — статистический клубок; ДНК — В-форма двойной спирали; поли (А+У)—А-форма двойной спирали; поли (А+2У)—тройная спираль; поли (А+А+) — двойная спираль, половина оснований в которой протонирована. Стрелками показаны изменения концентрационного инкремента скорости ультразвука в результате полной дегидратации двух атомных групп оснований, участвующих в образовании межнуклео — тидных водородных связей
Тать минимальным (максимальная гидратация) при условии, если гидратационный эффект аддитивен. Значение Кч для желатины [200], представляющий собой денатурированные, нерегулярные цепи коллагена, лежит выше, что связано с уменьшение] межцепочечных контактов. Для нативного же коллагена точка, лежит в два раза ниже «аддитивной», несмотря на то, что в нативных молекулах тоже есть межцепочечные контакты (молекула коллагена представляет собой три скрученные в спираль, полипептидные нити [203].) Эти результаты указывают на то, что жесткая молекула с регулярно расположенными полярными центрами на поверхности может оказывать на воду усиленное воздействие по сравнению с действием нерегулярных поверхностей или низкомолекулярных соединений. Такая особенность молекул с регулярным расположением полярных групп обсуждалась в работе [204], в которой исследовали гидратацию Сахаров.
Нуклеиновые кислоты. Основным типом организации вторичной структуры нуклеиновых кислот является двойная спираль, состоящая из двух полинуклеотидных цепей. Существует ли со стороны регулярной структуры спирали дополнительное — воздействие на воду по сравнению с воздействием отдельных нуклеотидов? Этот вопрос исследовался акустическим методом для различных типов спиральных структур полинуклеотидов [149]. В качестве гидратационной характеристики использовали концентрационный инкремент скорости ультразвука А, который связан с парциальными объемами и сжимаемостью соотношением
Где а и Ь — известные константы.
|
-S&a), СМ3/ПОЛЬ |
|
Поли (У ) |
|
Ц |
|
Поли (А) |
|
Н О’ V—// |
|
Лнк |
|
Попи (it] |
|
10- |
|
Попи (А*У) 20пола (А+2У) ^rnnujA*TV М гидратации из-за наличия |
На рис. 3.13 представлена шкала величин бЛад, представляющих собой разность между А и Лид, где А — экспериментальное значение для полинуклеотида, Лид — значение А полностью
развернутого полинуклеотида, имеющего такой же нуклеотид — ный состав. Значения Л нд рассчитаны по данным для компонентов нуклеиновых кислот. Значения бЛад рассчитаны по разности между экспериментальными значениями концентрационного инкремента скорости ультразвука и значениями, вычисленными по аддитивной схеме (из данных по нуклеоти — дам и нуклеозидам) для полинуклеотидов с разной вторичной структурой.
Наличие дополнительного воздействия на воду со стороны двойной спирали, по сравнению с суммой воздействий отдельных атомных групп, должно давать положительные значения •бЛад [149]. Если при образовании спирали изменение гидратации определяется лишь уменьшением доступности для воды атомных групп полинуклеотида, то бЛад должна быть отрицательна. Для всех исследованных спиральных структур, существенно различающихся между собой, бЛад<0 (см. рис. 3.13). По абсолютной величине значения бЛад вполне соответствуют тем, которые следует ожидать, если все гидратационные изменения при образовании спирали обусловлены только уменьшением доступности для воды атомных групп полинуклеотида [149]. Поэтому в случае нуклеиновых кислот имеющиеся экспериментальные данные свидетельствуют об отсутствии значительного дополнительного воздействия на воду со стороны регулярных спиральных структур, охватывающих значительные объемы вокруг макромолекулы.
Совокупность экспериментальных данных о термодинамических свойствах растворов органических соединений свидетельствуют о том, что изменения свойств воды вокруг органических молекул и их отдельных атомных групп затрагивают одну или, как максимум, две координационные сферы. Это заключение справедливо как для заряженных, так и для полярных и гидрофобных молекул и атомных групп. Свойства воды в пределах этого объема (гидратной оболочки) существенным образом зависят от типа атомной группы. Наиболее сильные изменения свойств воды наблюдаются в гидратных оболочках заряженных атомных групп. При этом происходит полная потеря присущих объемной воде аномальных свойств, таких, как немонотонные и нелинейные температурные зависимости плотности и сжимаемости, наличие большого структурного вклада в сжимаемость и др. В гидратной оболочке сближенных полярных атомных групп свойства воды также приближаются к свойствам нормальных жидкостей, однако в отличие от заряженных атомных групп эффект «нормализации» выражен гораздо слабее. Наименьшее воздействие на воду оказывают одиночные полярные группы, свойства воды в гидратной оболочке этих групп близки к свойствам чистой воды. Характеристики гидратных •оболочек гидрофобных атомных групп значительно отличаются от характеристик гидратных оболочек заряженных и полярных групп. Гидратная оболочка биополимеров, поверхность которых содержит заряженные, полярные и гидрофобные группы, может быть в первом приближении представлена как аддитивная сумма локальных изменений воды вблизи экспонированных в растворитель атомных групп.
 24 октября, 2012
24 октября, 2012  admin
admin 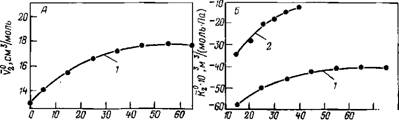
 Опубликовано в рубрике
Опубликовано в рубрике 