Перекись водорода (Н202). Является наиболее распространенным отбеливающим веществом. Она была открыта в 1818 г. французским ученым Л.-Ж. Тенаром и впервые предложена для отбелки в 1862 г. М. Шеврелем. Практически перекись водорода была использована для отбеливания тканей впервые в 1867 г. Тесье-дю-Мотеем. Большой вклад в химию неорганических пе — рекисных соединений внесли работы русских ученых: Д. И. Менделеева, Э. Б. Шене, П. Г. Меликова, Л. В. Писаржевского, А. Н. Баха, С. М. Танатора, И. А. Казарновского, Н. И. Кобозева, А. И. Бродского и др.
Перекись[17] водорода представляет собой бесцветную вязкую жидкость с «металлическим» привкусом; сЦ20= 1,4649; мол. вес 34,01; Гкип 150,2"С; Гпл — 0,43°С (легко переохлаждается).
Перекись водорода смешивается с водой в любых соотношениях, образуя кристаллогидрат Н202-2Н20.
Относительно структуры молекулы перекиси водорода существуют различные мнения. Твердо установлено наличие в молекуле перекиси водорода (как и в других истинных перекисях) пероксогруппы, так называемого «кислородного мостика» —О—О—(длина связи 14,8 нм *), или перекисного иона Of~ , который имеет электронную структуру: (:0—О:)2-, между двумя атомами кислорода — одна ковалентная связь. Установлено также, что молекула Н—О—О—Н не линейна, связи Н—О образуют углы со связью О—О примерно 95°, а между связями Н—О образуется угол 105—120°. Таким образом, структуру молекулы перекиси водорода можно представить следующим образом:
Н
|
|
(вид сбоку — вдоль связи О-О) (вид спереди)
Энергия связи О—О примерно в два раза меньше энергии связи О—Н; связь О—О непрочна и обусловливает неустойчивость молекулы перекиси водорода.
Химические свойства перекиси водорода. Многочисленные реакции перекиси водорода можно разделить на следующие группы:
1) процессы разложения;
2) реакции окисления;
3) реакции восстановления;
4) реакции переноса пероксогруппы;
|
Н |
|
|
5) реакции молекулярного (аддитивного) присоединения.
|
177 |
1. Почти одновременно с открытием перекиси водорода стала известной и реакция ее разложения. Внешне итоговая реакция разложения перекиси водорода выглядит просто:
2 Н202 = ? Н20 — I — 0?
Однако механизм процессов разложения очень сложен и до конца пока не изучен. Предполагается, что многие пути, по которым протекают процессы разложения, представляют цепные реакции. Занимая по степени окисленности промежуточное
* нм — нанометр, 1 нм = 10~9 м.
7 Заказ № 2217
Положение между молекулярным кислородом и водой, перекись водорода обладает как окислительными, так и восстановительными свойствами.
2. Примером чистой реакции окисления является следующая реакция:
Н202 + 2Fe? + 4- 2 Н+ = 2 Fe^ + + 2 Н20
Или
Н?0, 4- 2 FeS04 + H2S04 = Fe2(S04)3 -f 2 M20
3. В присутствии некоторых окислителей (KMn04, Ag20, СаОС12 и др.) перекись водорода ведет себя как восстановитель. Так, перекись водорода действует, например, при обесцвечивании кислого раствора перманганата калия *.
2 KMn04 + 5Н202 + 3H2S04 =2 MnS04 + K2S04 + 8НгО + 502
Эта реакция нашла широкое применение в аналитической химии, а также для удаления желтого налета перманганата после использования его для выведения пятен.
В щелочной среде реакция восстановления идет по другой схеме **.
2 KMri04 + 3 Н202 =2 Мп02 + 2 КОН + 2 Н20 + 3 02
|
* В этом случае протекают следующие электронные реакции:
|
|
** Электронные схемы реакции:
|
4. Перекись водорода обладает очень слабо выраженными Кислотными свойствами. В водном растворе она хотя и слабо, но диссоциирует на ионы по схеме:
Н202 Ч > н++ НС>2
Н02" Ч > н+ + 022 —
При взаимодействии перекиси водорода с гидроокисями некоторых металлов образуются соответствующие перекиси, т. е. фактически происходит перенос пероксогруппы. Эти перекиси можно рассматривать как соли перекиси водорода. Примером такой реакции обмена может служить следующая реакция:
Н202 + Ва(0Н)2=Ва02 + 2 Н20
Следует быть внимательным и не путать перекиси и двуокиси. Хотя эмпирическая их формула одинакова, например перекись бария Ва02, двуокись олова Sn02, структурная их формула различна:
Ва( I 0=Sn=0.
Х0
И если перекиси характеризуются наличием перекисного иона
[:б—б:]2- то в двуокисях присутствуют два обычных кислородных иона ^О:) 2. Характерны в этом отношении реакции перекисей и двуокисей с кислотами:
Ва02 + H2S04 = BaS04 + Н202
Sn02 + 2 H2S04 = Sn(S04)2 -(- 2 н2о
Т. е. первые реагируют с образованием перекиси водорода, а вторые дают воду.
5. Перекись водорода может аналогично воде в виде целой молекулы присоединяться к различным неорганическим (и органическим) веществам, образуя гидраты, которые называются Пероксогидратами [18], например:
ЗН202 + 2 Ыа2СС>з ——- >■ 2 Na2C03- 3H202
Способы получения перекиси водорода. Промышленное производство перекиси водорода было начато в Европе в 1879 г. В настоящее время ежегодно мировое производство перекиси водорода превышает 100 тыс. т.’ Рассмотрим основные способы производства перекиси водорода.
1. Классическим методом производства перекиси водорода является метод, основанный на использовании перекиси бария.
|
‘2 |
При нагревании углекислого бария с углем при температуре 145° С получается окись бария:
В.4СО3 + С = ВаО + 2 СО
При продувании воздуха над окисью бария под атмосферным давлением и при температуре 500—790° С окись бария окисляется в перекись.
2 ВаО + 02 = 2 ВаО.
Если затем на перекись бария подействовать 20%-ной серной или концентрированной фосфорной кислотой, можно получить перекись водорода:
Ba02 — t — H2S04 =BaS04 Н202 ВаО 2 + Н3РО4 = ВаНР04 + Н202
2. С появлением и развитием электрохимических методов производства перекиси водорода метод с использованием перекиси бария устарел и применяется редко.
Еще в 1878 г. Вертело открыл, что электролизом растворов серной кислоты можно получить пероксодисерную (надсерную) кислоту *, которая легко подвергается гидролизу в растворе с образованием перекиси водорода и серной кислоты. Известны три электрохимических метода промышленного значения:
А) использование персульфата (пероксодисульфата) калия — K2S2O8.
|
* Пероксосерные кислоты — кислородные кислоты серы, содержащие пе — роксогруппу — О — О —; известны три кислоты: пероксомоносерная H2SO5; пероксодисерная H2S2CV, пероксотрисериая H2S3O11. Лучше всего изучены H2S05 (кислота Каро) и H2S208, которая наиболее устойчива и имеет структурную формулу и гI
|
Процесс идет в три стадии:
Электролиз 2 NH4HS04 =(NH4)2S20a + н2
Осаждение (NH4)2S208 + 2 KHSO, =JK2S208 +2NH4HS04
Гидролиз K2S208 + 2 H20 = 2 KHS04 + Щ02
Б) использование надсерной (пероксодисерной) кислоты — H2S2O8.
Процесс идет в две стадии:
Электролиз: 1 H2SO4 = H2S208 + Н2
Гидролиз: H2S208 + 2 H20 = 2H2S04 — f Н202
В) использование персульфата аммония— (NH4)2S20s.
Процесс идет в две стадии:
Электролиз: 2NH4HS04 = (NH4)2S208 + Н2
Гидролиз: (NH4)2S208 + 2 Н20 = 2NH4HS04 — f Н202
Этот метод является наиболее распространенным. На его долю приходится 85% мирового электрохимического производства перекиси водорода.
Как правило, электролизеры [19] изготовляют из керамики и синтетических смол, анод — из платиновых лент или проволоки, для катода используют свинцовую трубку, через которую для охлаждения пропускают воду.
Электролизеры располагают каскадом в количестве от 7 до 20, причем через каждый пропускают электрический ток, как правило, 800—1200 а. По окончании электролиза раствор подвергают пиролитическому разложению. Отогнанную перекись водорода адсорбируют и получают в итоге 30—35%-ную перекись водорода.
3. Недостатками электрохимических методов получения перекиси водорода являются большой расход электроэнергии, пара и воды и необходимость применения химических продуктов и электродов с высокой степенью чистоты. Поэтому в последнее время в мировом производстве перекиси водорода наметилась тенденция в сторону так называемых неэлектрохимических методов. К ним относятся методы окисления углеводородов
и изопропилового спирта, методы, основанные на использовании азосоединений, и антрахиноновый метод. Промышленное применение получили только методы окисления изопропилового спирта и антрахиноновый.
Антрахиноновый метод имеет наибольшее практическое значение. В качестве исходного продукта в этом методе используют главным образом 2-алкилантрахинон и чаще всего 2-этилантрахинон.
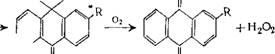
|
О Н ОН О |
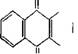
|
VH Н2 |
Процесс проводится по схеме:
Катализатор ^
Б 0 0 В начале проводится гидрирование антрахинона. Для этого берется 10—20%-ный раствор антрахинона в смеси жирного спирта (С7—Си) с алкилбензолом или алкилнафталином. Гидрирование проводится при температуре 30—50°С и давлении 1—2 атм. В качестве катализатора используется никель Ренея [20] или палладий на носителе (кремнезем, силикагель, активированный уголь). После гидрирования катализатор отфильтровывают и производят окисление гидроантрахинона посредством воздуха или кислорода, одновременно экстрагируя водой образующуюся перекись водорода. Температура процесса 30—35° С, давление — от нормального до нескольких атмосфер. Выход перекиси водорода по этому методу составляет около 90% по отношению к водороду.
Метод окисления изопропилового спирта считается особенно ценным, так как наряду с перекисью водорода получается и другой важный технической продукт — ацетон:
СН3-СН-СН3 о, Н20, + СНз-С-СН,
I ——> II
Он о
Процесс по этому методу можно вести как в жидкой, так и в паровой фазе. Выход перекиси водорода и ацетона по отношению к изопропиловому спирту составляет соответственно 70 и 90%.
Метод, основанный на использовании азосоединений, положил начало так называемым неэлектрохимическим методам производства перекиси водорода, однако до сих пор не получил широкого промышленного применения. Еще в 1932 г. Уол — тон и Филсон показали, что гидр азобензол в спиртовом или бензольном растворе может быть окислен воздухом или кислородом с образованием перекиси водорода и азобензола. Аналогичные результаты были получены и для других арилгидра — зосоединений.
Процесс идет в две стадии:
T катализатор
ВосстановлениеR-N=N-R + Н2 —————— > R-NH-NH — R
Окисление R—NH-NH-R’-f 02 — —> R—N=N —r’+ н202
В качестве катализатора при восстановлении используется амальгама натрия (HgNa) или кислый сульфид натрия (NaHS). Отечественная промышленность выпускает перекись водорода в виде прозрачной бесцветной жидкости без запаха следующих марок: техническая и медицинская (пергидроль) по ГОСТ 177—55, особой чистоты (ос. ч) по МРТУ 6-02-277-63 и экспортная 35%-ная (СТУ 12-10-135-61).
Перекись водорода техническая и медицинская. Выпускается в виде раствора с содержанием Н202 27,5— 31 вес. %. По соглашению с потребителем иногда выпускается раствор, содержащий до 40% Н202.
В перекиси водорода содержатся различные примеси (см. табл. 5).
Таблица 5
Допускаемое (максимальное) количество (г/л) Примесей в перекиси водорода
|
Примеси |
Медиции — ская |
Техническая |
|
|
Свободные кислоты в |
Пере- |
||
|
Счете на H2S04 . . |
0,3 |
0,6 |
|
|
Нелетучий остаток. |
0,6 |
1,65 |
|
|
Остаток после прокаливания |
0,25 |
0,55 |
|
|
Механические примеси (вор |
|||
|
Синки), гидроокись |
И фос- |
||
|
Фат алюминия. . . |
0,01 |
0,8 |
Для технической перекиси водорода допускается бледно- желтый оттенок. Медицинскую перекись водорода разливают в стеклянные бутыли емкостью по 20—40 л. Техническую перекись водорода заливают в специальные алюминиевые цистерны или другие алюминиевые емкости и в стеклянные бутыли емкостью не более 65 л.
На бутыли наклеивают надписи «Берегись ожога!»
Перекись водорода — неустойчивое соединение, поэтому хранить ее следует в условиях отсутствия прямого воздействия солнечных лучей при температуре окружающего воздуха не свыше 30°, так чтобы в бутыли не попадала пыль или какие-либо другие загрязнения.
Для стабилизации перекиси водорода, полученной электрохимическим методом, применяют пирофосфорнокислый натрий (Na4P207) или смесь пирофосфорнокислого натрия с салициловой кислотой (о-оксибензойная кислота)
|
|
Общее количество стабилизатора не должно превышать 0,6 г/л.
Перекись водорода, полученную неэлектрохимическим (органическим) методом, стабилизируют ортофосфорной кислотой (Н3Р04) или пирофосфорнокислым натрием, подкисленным ортофосфорной или серной кислотой.
Перекись водорода марки «Ос. ч» (МРТУ 6-02-277-63). Бесцветный прозрачный раствор, содержание Н2Ог—в пределах 30—35 вес. %, сумма определяемых примесей не должна превышать 8,0 -10-5, разливают в тару из полиэтилена емкостью 0,5; 1; 3; 10 и 20 л.
Перекись водорода экспортная 35%-ная (СТУ 12-10-135-61). Прозрачная слабо-желтая жидкость, допускается запах ароматических углеводородов, содержание Нг02 — в пределах 35—37 вес. %, срок хранения 6 месяцев.
Перекись водорода огнебезопасна, но при попадании на сухую стружку или опилки может вызвать пожар.
Перекись водорода нетоксична (предельно допустимая концентрация в СССР не установлена), но при попадании концентрированных растворов на кожу может вызвать ожоги. При постоянной работе с перекисью водорода мередки воспалительные заболевания кожи.
Перекись водорода является наиболее широко распространенным отбеливающим средством для тканей из любых волокон. Отбеливание перекисью водорода дает лучшие результаты по сравнению с хлорсодержащими отбеливателями как по степени белизны, так и по меньшему снижению прочности бельевой ткани.
Однако до сих пор механизм отбеливающего действия перекиси водорода точно не установлен. До последнего времени общепринятым считалось предположение, что отбеливающим действием якобы обладает выделяющийся при разложении перекиси водорода атомарный (так называемый «активный») кислород.
Н2°2 =Н20 + О
Однако это неверно. По современным представлениям белящее действие перекиси водорода обусловливается ионом пер — гидроксила НОГ, который образуется в результате диссоциации перекиси: +
Н2о2 н + но;
Повышение щелочности раствора снижает концентрацию водородных ионов и соответственно увеличивает концентрацию ионов пергидроксила. Поэтому с повышением рН раствора возрастает и скорость отбеливания. Наилучшие условия для отбеливания белья из хлопчатобумажных и льняных тканей: температура 80-ь 95° С, рН 10-+-12.
Кислород же, выделяющийся при разложении перекиси водорода, как правило, лишен отбеливающего действия и часто оказывается даже вредным. Так, например, целлюлоза в сильнощелочной среде подвергается окислению и переходит в окси — целлюлозу. Как следствие этого процесса — снижение прочности бельевой ткани.
На основании проведенных автором исследований был составлен следующий баланс расхода перекиси водорода при отбеливании белья:
0 = А + Б + В + Г + Д + Е,
Где О — общее количество перекиси водорода, взятое для отбеливания;
А — количество перекиси водорода, пошедшее на разрушение и обесцве чивание окрашенных загрязнений, закрепленных на волокне (не отстиранных);
Б — количество перекиси водорода, пошедшее на разрушение и обесцве чивание окрашенных загрязнении, находящихся в растворе (отсти ранных);
В — количество перекиси водорода, пошедшее на окисление целлюлозы, а следовательно, и разрушение волокна;
Г — количество перекиси водорода, разложившееся с выделением кислорода (в виде пузырьков);
Д — количество перекиси водорода, пошедшее на коррозию оборудования;
Е — неиспользованное количество перекиси водорода, слитое вместе с раствором в канализацию.
При анализе данного баланса становится очевидным, что необходимо повысить показатель А, а все остальные показатели снизить до минимума.
Показатель Б снижают отбеливанием в относительно чистом растворе.
Показатель Г снижают правильным приготовлением рабочего 3%-ного раствора перекиси водорода: холодная чистая вода, полиэтиленовая или эмалированная посуда; рабочий раствор приготовляют непосредственно перед отбеливанием.
Показатели В и Д снижают, используя стабилизаторы. Стабилизирующее действие на разложение перекиси водорода оказывают мыла и особенно синтетические моющие средства (алкилсульфаты, фосфаты и полифосфаты и, особенно, силикат натрия).
Как установлено, процесс разрушения окрашенных загрязнений является некаталитическим, а процесс окисления целлюлозы— каталитическим. Поэтому применение стабилизаторов не мешает прохождению первого процесса, с одной стороны, а с другой — тормозит прохождение второго процесса, что снижает потери прочности волокна.
Силикат натрия действует и как стабилизатор, обеспечивающий равномерность процесса отбеливания, и как буфер, поддерживающий рН раствора на необходимом уровне. Вместе с тем силикат натрия является ингибитором коррозии и, следовательно, снижает показатель Д.
Показатель Е снижают регулированием времени процесса отбеливания и температуры раствора. Для полного использования установленной нормы перекиси водорода (для прачечных такая норма равна 3—4 г 30%-ной перекиси водорода на 1 кг Сухого белья) необходимо время 10—15 мин и температура 80—95° С.
До недавнего времени в прачечных белье отбеливалось во время второго полоскания после стирки. При этом до 60% перекиси водорода расходовалось непроизводительно. На основании проведенных исследований автор предложил проводить отбеливание хлопчатобумажного и льняного белья перекисью водорода и персолями в третью стирку (при трехваииом режиме) или за 10—12 мин до окончания второй стирки (при двухван — ном режиме). Как показала практика работы фабрик-прачечных г. Москвы, применение предложенного автором режима отбеливания позволяет снизить потери перекиси водорода (показатели Б, В, Г, Д, Е) до 20%, повысить белизну белья и снизить потери прочности бельевой ткани.
Перекисные соли. В последнее время широкое распространение для отбеливания белья получили перекисные соли (персоль). По внешнему виду персоль представляет собой белый кристаллический порошок. По сравнению с перекисью водорода персоль более устойчива при хранении и очень удобна в применении. При правильной дозировке она дает высокую белизну при наименьших потерях прочности бельевой ткани.
К персолям относятся перборат и перкарбонат [21] натрия, перфосфат натрия и персульфат калия. Лучшим является перборат натрия. Наличие в нем бора кроме белизны придает белью очень эффектный блеск. Но в связи с тем что персоли обладают сильной щелочностью, применять их следует в основном только для белья из хлопчатобумажных и льняных тканей.
Перборат (гидрат пероксигидрат метабората) натрия
NaBCy Н202- 3 Н^О
Строение пербората натрия до сих пор точно не установлено. Предполагают, что оно имеет следующий вид:
Н2о, ОН2
NaO — Х= О
Представляет собой белый кристаллический порошок, растворяющийся в воде с отщеплением кристаллизационной перекиси водорода. Содержание «активного кислорода» в нем — 10,38%; плотность—1,731, температура плавления 65—66° С.
Промышленный способ получения пербората натрия состоит из следующих операций.
1. 10%-ный раствор едкого натра в дистиллированной воде смешивают с бурой, получая раствор метабората натрия рН 9,4—9,9.
Na2B407 + 2 NaOH = 4 N’aВ 02 — j — Н20 Бура
К раствору добавляют стабилизаторы, например, метасиликат натрия, сернокислый или хлористый магний и перемешивают в течение 1—2 ч. Затем декантацией отделяют раствор метабората натрия от осадка силиката магния.
2. К полученному раствору, подогретому до 30—60° С, добавляют раствор перекиси водорода и «затравку» из кристаллов пербората. Полученную смесь быстро охлаждают до 10—15° С.
NaB02 + Н202 + 3H20=NaB02-H202-3H20
Выдержав смесь в течение 4—7 ч, получают плотный осадок пербората, который затем отделяют от маточного раствора центрифугированием.
3. Сушка кристаллов пербората «атрия при комнатной температуре.
4. Остатки пербората регенерируют путем охлаждения маточного раствора в кристаллизаторе при температуре от —1 до + 2° С. Выход готового продукта составляет 95—96%.
Перборат можно также получить путем электролиза раствора буры и карбоната натрия, применяя платиновые электроды:
Na2B407 -f 2 Na2C03 + 2)H20= 4 (№B02- H202- 3H20) + 2 NaHC03-b 4 Н2
По сравнению с перекисью водорода перборат натрия чрезвычайно устойчив. Так при хранении в открытом сосуде в течение года он теряет лишь 0,1% «активного кислорода», а в течение двух лет — 0,22 %.
Хранить перборат натрия лучше всего в сухом прохладном месте. Как уже было сказано выше, перборат натрия применяют
Для отбеливания белья и одежды, а также в качестве окислителя при крашении кубовыми красителями.
Перкарбонат (гидрат пероксогидрат карбоната) натрия Na2C03-l,5 НгОг-НгО представляет собой мелкокристаллический белый порошок с содержанием «активного кислорода» в количестве 14—15 вес. %, Перкарбонат получают при взаимодействии насыщенного раствора карбоната натрия (рН 11) с 30—35%-ным раствором перекиси водорода.
Перекись водорода содержит стабилизатор (Si02, силикат магния и др.). Получившийся раствор перкарбоната кристаллизуют при температуре ниже 5° С, образовавшиеся кристаллы отфильтровывают на центрифуге. Кристаллы сушат при температуре около 100° С. Маточный раствор упаривают при 25—50° С и давлении 24—100 мм рт. ст. в течение 2— 10 мин, а образовавшуюся суспензию возвращают в зону кристаллизации. Выход продукта составляет 85%.
Перкарбонат натрия дешевле пербората натрия и благодаря этому получил широкое распространение. Отечественная промышленность выпускает перкарбонат натрия под названием «Персоль» СТУ 49—158—62, который содержит «активного кислорода» не менее 15%, влаги не более 3%. Персоль расфасовывают в двойные бумажные пакеты (весом по 60 г). Перкарбонат следует хранить в закрытом сухом месте при температуре не выше 25° С. Хранение в одном помещении с испаряющимися кислотами запрещено, срок хранения 12 месяцев.
Перфосфат (пероксогидрат пирофосфата) натрия
Na4P207 • хН202 . где * = 1тЗ
Его получают, растворяя на холоду одни моль пирофосфата натрия в трех молях концентрированной перекиси водорода. Образующийся раствор перфосфата натрия затем подвергают выпариванию под вакуумом. Перфосфат натрия является очень мягким окислителем, но он менее стоек, чем другие персоли.
Персульфат (пероксодисульфат) калия Кг^гОа является солью пероксодисерной (надсерной) кислоты (см. примечание на стр. 180). Представляет собой кристаллический белый порошок, содержащий около 5% «активного кислорода»-, очень устойчив при хранении в контакте с воздухом. В промышленных масштабах персульфат калия получают из персульфата аммония. .
(NH4)2S208 — t — 2 KHS04 =jK2S208 + 2 NH4HSO4
Осадок персульфата калия центрифугируют и сушат. Персульфат калия гидролизуется при комнатной температуре с образованием бисульфата калия и перекиси водорода.
K2S208 + 2 Н20 = 2 KHS04 + Н202
Недостатком персульфата калия является его плохая растворимость в воде. При 15° С растворяется всего 3,8 вес. % персульфата калия.
 19 ноября, 2012
19 ноября, 2012  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 