Теория цветности органических соединений рассматривает связь между строением молекулы вещества и его цветом. Она возникла около ста лет назад почти одновременно с появлением первых синтетических красителей.
Исторический очерк. В 1868 г. Гребе и Либерман впервые заметили, что окрашенные органические вещества обесцвечиваются при гидрировании (присоединении водорода). На основании этого они пришли к выводу, что цвет является следствием ненасыщенности молекул.
В 1876 г. О. Витт выдвинул хромофорно-ауксохромную [37] теорию, которая была первой попыткой связать явление цветности со строением молекул.
По этой теории все окрашенные органические вещества содержат хромофорные группы, вызывающие появление цвета.
Основными хромофорными группами считаются следующие:
— N = О нитрозогруппа
— Ny нитрогруппа Ю
— N — N — азогруппа
— N — СН — азометиновая группа — СН = СН — этиленовая группа
^>С ~ О карбонильная группа
Вещества, содержащие хромофорные группы, называются хромогенами. Такие вещества еще не являются красителями, так как цвет их обычно слабый и они не способны связываться с текстильным волокном. После введения в хромоген таких групп, как — ОН; —OR; — NH2; — NHR; — SH и др., названных ауксохромами, соединение приобретает сродство к волокну и окраска его становится интенсивнее. Например, благодаря
наличию хромофора (—N = N—) азобен — —N=N-
Зол имеет оранжевый цвет, но с введением ауксохрома (—ОН) оксиазобензол приобретает красную окраску:
В 1882—1892 гг. Армстронг и Нецкий разработали хиноид- ную теорию, согласно которой все красители являются производными хинонов и цвет красителей объясняется их строением. Действительно, большинство красителей может быть представлено в хиноидной форме. Многие красители при восстановлении превращаются в бесцветные лейкосоединения [38], в которых отсутствует хиноидная форма; например, синий индиамин переходит в бесцветный диаминодифениламин.
![]()
|
Синий индиамин |
|
HN=< >=N—————— <f >-NHs |
|
Диаминодифениламин |
Хиноидная теория позволила наиболее строго классифицировать красящие вещества и дать рациональное объяснение многочисленным наблюдениям в области химии красителей.
Ограниченность хиноидной теории заключается в том, что она не объясняет причин возникновения цвета у многих красителей, которые не могут быть представлены в хиноидной форме.
Основные положения современной теории цветности. Ощущение цвета возникает при воздействии на окончания зрительных нервов электромагнитных излучений с длинами волн 400— 760 нм[39]. Электромагнитные излучения этого интервала составляют видимую часть спектра, излучения с длиной волны более 760 нм называют инфракрасными, а с длиной волны менее 400 нм — ультрафиолетовыми.
Если пропустить солнечный луч через стеклянную трехгранную призму, то он разлагается на ряд цветных лучей. Разложение (дисперсия) белого света объясняется тем, что лучи различных цветов, составляющие белый свет, при прохождении через призму отклоняются под различными углами; при выходе из призмы получается расходящийся пучок цветных лучей, который при проектировании на экран образует чередующиеся окрашенные полосы, составляющие солнечный спектр.
Основные цвета солнечного спектра располагаются в следующем порядке: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый. Совместное действие лучей этих цветов вызывает ощущение белого света.
Тело кажется белым, если оно полностью отражает все лучи видимой части спектра, черным — когда полностью их поглощает. Если же тело избирательно поглощает некоторые лучи видимой части спектра, то оно кажется окрашенным.
Тело при этом принимает цвет непоглощенных (отраженных) лучей, которые и воспринимаются глазом. Поглощенные и непоглощенные лучи являются поэтому дополнительными. Вещество окрашено в цвет, дополнительный к тому, который поглощается.
Краситель, поглощающий красные лучи, обладает зеленым цветом, поглощение желтых лучей дает ощущение синего цвета. В учении о цветности изменение цвета от желтого через красный и синий к зеленому называется углублением цвета (или бато — хромным эффектом). Обратный переход называется повышением цвета (или гипсохромным эффектом).
В табл. 8 приведены длины волн видимого света, соответствующие цвета спектра и цвета, дополнительные к ним.
|
Таблица 8 Длины воли видимого свста
|
|
Рис. 8. Кривая поглощения света |
Поглощение света веществом характеризуется кривой поглощения, которая строится на основе измерения интенсивности поглощения света определенных длин волн, рассчитываемой по закону Ламберта—Бера:
Igj =eCd,
Где /0 и I — интенсивности света до и после прохождения через слой толщиной D (см) раствора вещества с концентрацией С (моль/л). Величина е называется молярным коэффициентом поглощения. Кривая поглощения обычно строится в координатах: коэффициент поглощения е— длина волны X (см. рис. 8).
Длина волны, при которой имеет место наибольшее поглощение, обозначается Ямакс и характеризует цвет. На рис. 8 Ямакс — 500 нм. Из этого следует, что вещество наиболее интенсивно поглощает свет в сине-зеленой части спектра и окрашено в красный цвет( дополнительный к сине-зеленому). Максимум на оси ординат (еМакс) характеризует интенсивность окраски.
Физические основы поглощения света. Как известно, монохроматический (одноцветный) луч света представляет собой поток фотонов — отдельных порций (квантов) энергии. Энергия фотона Е обратно пропорциональна длине волны светового потока: E — h^,
Где H — постоянная Планка, равная 6,62 • 10~34 дж-сск С — скорость света, 3 • 108 м/сек = 3• 1017 нм/сек; К — длина волны.
Таким образом, чем больше длина волны светового потока, тем меньше энергия кванта.
Поэтому по мере перехода от фиолетового к красному цвету спектра энергия кванта уменьшается, а длина волн светового потока увеличивается.
Различные вещества способны поглощать лишь фотоны со строго определенной энергией и их окрашивание в соответствующий цвет будет зависеть от энергии фотонов, поглощаемых данным веществом из светового потока белого света.
При действии света на молекулу красителя кванты лучистой энергии поглощаются электронами, которые при этом переходят на более высокие энергетические уровни. Энергия, необходимая для такого перехода, называется энергией возбуждения. Энергия возбуждения, соответствующая поглощению света в начальной части видимого спектра (400 нм), равна 298 кдж/моль, в конце видимого спектра (760 нм)—около 147 кдж/моль.
Следовательно, величина энергии возбуждения электронов молекул веществ, поглощающих свет в видимой части спектра (и, значит, окрашенных) должна находиться в пределах от 147 до 298 кдж/моль. С уменьшением энергии возбуждения максимум поглощения (ХМакс ) смещается в длинноволновую часть спектра. При эгом окраска изменяется от желтой к оранжевой, красной и т. д. Таким образом, цвет вещества зависит от величины энергии возбуждения. Уменьшение энергии возбуждения (соответствующее углублению окраски) связано с увеличением Подвижности электронов.
В окрашенных соединениях связь электронов с ядром ослаблена, вследствие чего энергия лучей видимого света оказывается достаточной для возбуждения электронов. Чем подвижнее электроны, тем меньшее количество энергии необходимо для их перехода в возбужденное состояние, т. е. тем больше длина волны света, который поглощает молекула, и тем глубже окраска вещества. Ниже будут подробно рассмотрены причины, обусловливающие повышенную подвижность электронов и перераспределение плотности электронного облака в молекулах красителей.
В органических соединениях различают два типа химической связи: а-связь, осуществляемую ог-электронами и я-связь, в образовании которой принимают участие я-электроны.
В предельных соединениях присутствуют только а’-связи. Для возбуждения а-электронов требуются весьма большие кванты энергии, поэтому насыщенные соединения поглощают свет в ультрафиолетовой части спектра и воспринимаются человеческим глазом как бесцветные.
В силу особенностей своего расположения наиболее подвижны электроны я-связей. Поэтому для перевода я-электронов на более высокий энергетический уровень требуются кванты света значительно меньшей величины, чем для электронов ог — связей. Особой подвижностью обладают я-электроны в органических соединениях с сопряженными двойными связями.
Поглощение света смещается в длинноволновую область тем значительнее, чем длиннее система сопряжения.
Накопление сопряженных двойных связей в молекуле окрашенного вещества снижает энергию возбуждения электронов, вследствие чего углубляется окраска. В табл. 9 проиллюстрирована зависимость между цветом вещества и длиной сопряженной цепи.
Еще Витт заметил, что присоединение к сопряженной цепи некоторых заместителей вызывает углубление окраски (хромо — форно-ауксохромная теория). Понятия об ауксохроме и хромофоре сохранились, но вкладываемый в них смысл изменился.
В настоящее время под хромофором подразумевают цепь сопряжения простых и двойных связей, наличие которой при достаточной ее длине вызывает появление окраски даже у углеводородов.
Под ауксохромом подразумевают атомы или атомные группы, содержащие необобщенные электронные пары (доноры электронов или электронодонорные заместители):
— NH2; — NHR; — NR2; — 0Н; = 0;
Или группы атомов, способные воспринимать электроны (акцепторы электронов или электронофильные заместители):
-Чо°, >С=0 и др.
В молекулах красителей ауксохромы находятся на концах цепи сопряжения. Доноры передают свои электроны на цепь, акцепторы их воспринимают.
Присутствие на концах сопряженной цепиэлектронофильных и электронодонорных заместителей вызывает постоянное смещение я-электронов. Совместное действие этих заместителей
Таблица 9
Зависимость между длиной сопряженной системы и максимумом поглощения
|
А макс, hiv |
|
Цвет |
Соединение
|
|
|
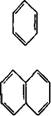
Бензол |
|
255 |
|
Нафталин |
|
275 |
Бесцветный
Бесцветный
|
|
|
Антрацен |
|
37 о |
Бесцветный
|
|
|
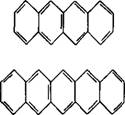
Тетрацен |
|
460 |
|
Пентацен |
|
580 |
Оранжевый
Снне — фиолетовый
|
|
|
Гегсацен |
|
693 |
Темно-зеленый
Снижает энергию возбуждения и сдвигает поглощение в сторону более длинных волн. В табл. 10 показано влияние одного заместителя (электронодонорного или электроноакцепторного) и совместное действие заместителей противоположного характера.
Существенное влияние на цвет и его интенсивность оказывают пространственные препятствия сопряжению, возникающие
Таблица 10
|
А маке нм |
Влияние электроиодонорных и элекгрофильных заместителей на максимум поглощения
Соед и не ми е
1- Исходная сопряженная система Бензол
2v Влияние электронолонорных заместителей
/— /Н
Анилин <f 5—N4
Н
41
|
Фенол |
|
ОН |
|
Анизол |
|
/ |
Днметиланнлин ^ ^—
/V-П
/~Л_осн3
3 Влияние элекгроиофнльных заместителей Нитробензол
/ V-N=o
Нитрозобсчпол
4 Совместное лейстпие электронолонорных и элекчроно — фильиых 3^ местителеГ;
И-Нитрофенол Н —О—И;
П — Нтроанилпн
СН, • / п-Нитрочолиметилапилин J>N—0 у~
|
А-Нитрозоаиизол СНз—О |
Сп( v —
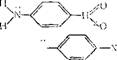
В молекуле красителя. Максимальное перекрывание орбиталей я-электронов, образующих цепь сопряжения, достигается при расположении всех звеньев цепи в одной плоскости. Такое расположение называется копланарным. Например, в азокрасителе:
Н3с —ч
Н3с
Ауксокромы (диметиламииогруппа и нитрогруппа) и хромофор (два бензольных кольца и азогруппа) находятся в одной плоскости. Если в ортоположение к диметиламиногруппе ввести углеводородный радикал большого объема, то диметиламииогруппа выйдет из плоскости ядра и ее влияние на цвет ослабляется, так как затруднено взаимодействие неподеленной электронной пары азота с я-электронным облаком ароматического ядра. Ниже приведены данные, показывающие, как с ростом объема заместителя R поглощение смещается в коротковолновую часть спектра, цвет повышается (гипсохромный эффект).
Заместитель, *Макс’ нм
Н 475
СНз 438
Изо-С3Н17 420
Следовательно, при введении заместителей, вызывающих поворот ауксохрома по отношению к плоскости ароматического ядра, цвет красителя повышается.
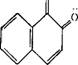
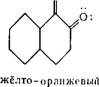
Цвет повышается и в том случае, когда пространственные помехи возникают в цепи сопряжения красителя и вызывают поворот целого ароматического ядра относительно другой части молекулы. Так, бесцветность бензофенона можно объяснить нарушением плоскостного строения частей молекулы вследствие поворота отдельных ее частей, в то время как флуоренон, в котором вращение исключено, имеет оранжевую окраску:
Д |Т
О о
Бепзофенон флуоренон (бесцветный) (оранжевый)
В бензофеноне возможен поворот одного бензольного ядра относительно плоскости второго. Наличие же в молекуле флуо — ренона непосредственной связи между бензольными ядрами делает вращение невозможным.
В технологии протравного крашения большое значение имеет комплексообразование, оказывающее влияние на цвет красителя. В получающихся внутрикомплексных соединениях красителя с металлом координационная связь образуется за счет неподе — ленной пары электронов атома, входящего в молекулу красителя (например, азота, кислорода и др.). При этом изменение цвета органического соединения происходит лишь в том случае, если в комплексообразовании (обычно с Cr+3, Fe+3, А1+3, Cu+2) участвуют своими неподеленными электронами атомы цепи сопряжения.
Например, оранжево-желтый цвет нитрозо-р-нафтола углубляется до коричневого при образовании внутрикомплексного соединения с хромом:
|
|
N=OH N=0—а
|
|
В этом комплексном соединении атом металла связывается с одним атомом кислорода, замещая водород, а со вторым атомом кислорода образует координационную связь (указана стрелкой) за счет одной из двух свободных электронных пар.
 19 ноября, 2012
19 ноября, 2012  admin
admin 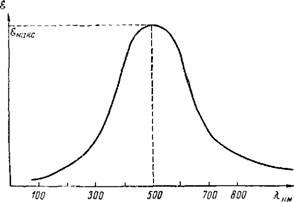
 Опубликовано в рубрике
Опубликовано в рубрике 