Сн
НсУ^сн „„
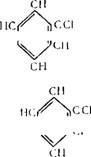
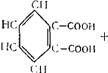
Бензол СвНв „_ df= 0,879; мол. вес. 78,108.
СН
Сн
Прозрачная бесцветная легкоподвижная жидкость, имеющая своеобразный запах; Тип—5,53°С; Гкип 80,1°С.
Бензол — простейший представитель ароматических углеводородов, он был впервые выделен М. Фарадеем в 1825 г.
Бензол смешивается во всех соотношениях с неполярными растворителями (бензол, скипидар, эфиры, хлороформ), хуже растворяется в метиловом спирте, не растворим в этиленгли — коле, глицерине, с водой образует азеотропную смесь (91,17 вес. % бензола), которая кипит при температуре 69,25°С.
Бензол легко реагирует с галогенами, азотной и серной кислотой с образов:анием продуктов замещения.
Для бензола характерна устойчивость ядра к действию окислителей— хромовой кислоты, перманганата калия и др.
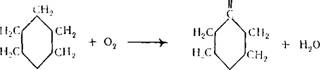
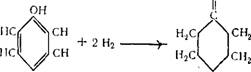
Бензол легко присоединяет водород в присутствии катализаторов (никель, сернистый молибден и др.), образуя при этом циклогексан [3].
Большое практическое значение имеют реакции алкилирова — ния бензола, в результате которых получают полупродукты, используемые для производства важнейших химических продуктов, например полистирола, фенола, красителей и других.
Бензол содержится в коксовом газе, каменноугольной смоле, а также в некоторых разновидностях нефти (майкопская нефть).
Основным методом получения бензола служит пиролиз нефтяного сырья.
Бензол можно также получить при нагревании ацетилена до 900° С.
В смеси со спиртом бензол растворяет ацетилцеллюлозу. Бензол горит сильнокоптящим пламенем. Пределы воспламеняемости паров в воздухе 1,4—8,0 об.%, Т^осм 10,7°С.
Бензол чрезвычайно токсичен, его пары действуют на центральную нервную систему, вызывают малокровие. Хроническое отравление парами бензола может вызвать смерть.
Бензол довольно сильно раздражает кожу, вызывая зуд и красноту. Предельно допустимая концентрация паров бензола в воздухе 0,02 мг/л.
Отечественная промышленность выпускает бензол согласно ГОСТ 84—48 — бензол чистый каменноугольный и согласно ТУ МНП 2—58 — бензол чистый нефтяной. Бензол транспортируют и хранят в чистых сухих цистернах и стальных бочках, на которых должна быть сделана надпись «Яд!».
Бензол хорошо растворяет жиры, смолы, каучук, серу, йод.
Ввиду своей токсичности бензол на фабриках химической чистки применяют редко, только для удаления трудно растворимых жирных пятен, которые почему-либо нельзя было удалить при помощи других растворителей.
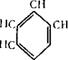
Хлорбензол С6Н5С1 (ГОСТ 646—60); d420= 1,106; мол. вес. 112,557.
Прозрачная бесцветная жидкость с характерным миндальным запахом, плохо растворим в воде, но с большинством органических растворителей смешивается во всех соотношениях.
В промышленности хлорбензол получают при каталитическом хлорировании бензола в жидкой фазе или в паровой — смесью хлористого водорода с воздухом или кислородом
|
Т l-lj —————— тт Катализатор re Сн |
|
I = 75-85° + CI,———— D*- + HCI |
|
|
|
I — °5С° + 2 11CI + О, , > 2 21/ о — C. uCl, Г|1 ‘ |
Хлорбензол огнеопасен, пределы взрываемости паров в воздухе 1,35—7,05 об.%. Хлорбензол токсичен и оказывает довольно сильное физиологическое действие на организм, предельно допустимая концентрация его паров в воздухе 0,05 мг/л.
Хлорбензол выпускается согласно ГОСТ 646—60 марки А (1 и 2 сорта) и марки Б.
Технический хлорбензол представляет собой прозрачную бесцветную жидкость без механических примесей со слабым ароматическим запахом, допускается незначительная окраска. Содержание хлорбензола — не менее 98,6%, плотность — в пределах 1,112—1,114 г/см3.
Хлорбензол транспортируют в железнодорожных цистернах и стальных бочках емкостью 100—250 л.
Хлорбензол хорошо растворяет масло, жиры, смолы, каучук, но ввиду своей токсичности его при выведении пятен применяют сравнительно редко.
|
|
|
СНОН |
|
С=о
|
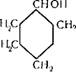
Циклогексанол (оксициклогексан, гексагидрофенол, гекса — лин, анол) сЦ25 = 0,9493; мол. вес 100,16.
Снон Ун2
Бесцветные гигроскопичные кристаллы с запахом камфары; Гпл 25,15° С; Гкип 161,1° С (760 мм рт. ст.).
Циклогексанол растворим в спирте, эфире. В 100 г воды при температуре 30° С растворяется 4,3 г циклогексанола. С водой циклогексанол образует также азеотропную смесь, которая кипит при температуре 97,9°С (21% циклогексанола).
При окислении циклогексанола он переходит в циклогекса — нон. Для этого циклогексанол в виде паров пропускают над металлической медью или солями кобальта при температуре 200—300° С.
При действии хлора в водной среде в присутствии углекислого кальция циклогексанол образует 2-хлорциклогексанон:
С=0
СаСО, Н„СГ ] CHCI
+ 2СЦ——— »- Ч _„ + 3HCI
СН2 HC<v JCH,
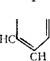
При дегидрации циклогексанола образуется циклогексен:
Н2сА, СН2 А.,О, Н. с/ЛСП +Нг0
HjCv. JcH2 380-450° н2с1ч^//1сн2 СН2 СН2
При взаимодействии циклогексанола с бензолом (реакция Фриделя — Крафтса) образуется циклогексилбензол:
TOC o "1-3" h z Н2с сн2 не_ сн
^)сНОН + НС<^ ^Сн ————————-
HjC СН2 НС сн
НС__ СН2 НС__ СII г
—- ^Hf/ )сн — с/ сн + Н20
Н2С С112 НС СН
Циклогексанол получают следующим образом.
1. При каталитическом гидрировании фенолов, реакция протекает в газовой фазе при температуре ~ 180°С над никелем или в жидкой фазе под давлением водорода. При этом получается также и циклогексанон:
СОН снон
|
НС^^СН Н2С + 3 н,—— >- Сн н2с |
СН;,
С Но
2. При окислении циклогексана’ воздухом в жидкой фазе при температуре 100—140° С в присутствии солей кобальта или марганца. При этом получается циклогексанол и циклогексанон почти в равных количествах:
|
|
Снон
Циклогексанол растворяет ацетилцеллюлозу, на другие волокна не действует.
Циклогексанол горюч, температура вспышки 67,2°С.
Циклогексанол малолетуч и малотоксичен, но при высоких концентрациях его пары могут вызвать раздражение слизистой оболочки глаз, носа и горла; предельно допустимая концентрация паров в воздухе 0,01 мг/л.
Циклогексанол выпускают согласно ТУ БУ 1—53. Технический циклогексанол-ректификат представляет собой прозрачную бесцветную маслянистую гигроскопичную жидкость, плотность (d420) 0,944—0,945, содержание воды не более 0,05%, температура застывания не ниже +24° С.
Циклогексанол транспортируют и хранят в герметически закрытых стальных бочках серого цвета или в бутылях с притертой пробкой.
На таре должна быть надпись «Огнеопасно».
Срок хранения 3 месяца.
Циклогексанол является хорошим растворителем масел, жиров, смол, восков, каучука, нитроцеллюлозы. Он входит в состав пятновыводных средств и усилителей.
При нагревании циклогексанол растворяет мыло и после разбавления водой получают почти прозрачные мыльные растворы, обладающие хорошими моющими и эмульгирующими свойствами.
Мыльные растворы циклогексанола могут растворять и эмульгировать определенные количества таких не растворимых в воде растворителей, как бензин, четыреххлористый углерод.
|
Н, с |
|
/ч |
|
Сн,. |
Образующиеся эмульсии обладают большой устойчивостью.
Циклогексанон (анон, нимелинкетон) d420 = 0,946; мол. вес. 98,14.
О II
Бесцветная маслянистая подвижная жидкость с ацетоново- мятным запахом, температура кипения 155,6°С.
Циклогексанон смешивается с большинством органических растворителей. В воде при температуре 20°С растворяется примерно 7% циклогексанона; 8,7% циклогексанона образуют с водой азеотропную смесь.
При гидрировании циклогексанона амальгамированным цинком и соляной кислотой он восстанавливается до циклогексана.
|
О II С |
|
Сн, ha^NCH,, |
|
О |
|
Сн, |
|
11,с Н |
|
LJCH, Сн, |
|
НпО |
|
+ 2113" |
|
Uf |
|
Сн, |
При интенсивном окислении циклогексанона азотной кислотой или перманганатом калия кольцо рвется и получается адипиновая кислота.
|
О II С |
|
СООН ‘ С ООН СН, |
|
О |
|
Н, с Н£ |
|
НоС |
![]()
|
Н2С |
■г СН2
Или НООС-(СН,,),-сООП
Для ускорения реакции используется смешанный медно — ванадиевый катализатор.
При окислении циклогексанона двуокисью селена получается дикетон-1,2-циклогександион:
|
? с |
|
О |
|
О СН, |
|
С Но |
|
Н2С Н, С |
|
[С«0 С Но |
|
ScO, |
|
Сн, |
|
Н2С |
|
Ч/ Сн2 |
При окислении надкислотами, например надуксусной кисло — той, СН3с^—о—он циклогексанон переходит в е-капролакт:
Н2с сн.
У
М, с сн2
|
■•С |
,Н2С—СНг—С=0 Н2С/ I + СНзСООП
L2c—СН2-0
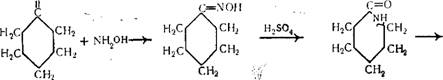
При обработке циклогексанона хлористоводородным гидро — ксиламином получается циклогексаноноксим. Затем под действием серной кислоты происходит перегруппировка циклогек — саноноксима в е-капролактам, из которого в дальнейшем получают синтетическое волокно капрон:
О
|
*- [—СО — N Н—(С Н з)—]« |
|
<111 |
При взаимодействии циклогексанона с диазометаном СН:
Происходит расширение цикла, в результате чего получается циклогептанон, циклооктанон и эпоксид:
|
О II С |
|
О II С |
|
Сн, |
|
Н, С И, с. |
|
СН, |
|
Сн2 |
Сн2 СН2М,; СН30Н;(С, П5),0 Н2С
|
Сн, |
Н, С— ;0
|
Сн2 CHj |
|
+ |
|
Н, с! |
НпС
О
|
|
Циклогексанон вступает в реакцию аутоконденсации, при этом образуется циклогексенилциклогексанон:
Н2С___ СН2 С СН2
Hic/">c-o + HfOcH, ЭЙ»*
Н2с сн2 Н2С сн2 о
В присутствии метилового спирта и серной кислоты происходит аутоконденсация трех молекул циклогексанона, при этом получается интересный тетрациклический углеводород —
|
/ |
|
С Но |
Додекагидротрифенилен, кристаллизующийся в виде больших блестящих игл:
СИ,
Н2С
1 CH3OII, H2SO<
С /1
Н2с
|
112С Н, с |
СП,
СИ,
V
СП,
|
/ |
|
П.,с |
■c./Nci
Суси2 С У сп, Посг ^
‘СИ,
СП,
В промышленности циклогексанон получают каталитическим дегидрированием циклогексанола:
II
![]()
|
СП, Сн.. |
![]()
|
Си ; 250° Г. п, —————- У |
|
II..с Н2С |
|
Сн, |
С
|
О
Сн, сн. |
Циклогексанон растворяет ацетилцеллюлозу и некоторые основные красители. Циклогексанон огнеопасен, температура воспламенения (в открытой чашке) 54° С, взрывоопасная концентрация паров в воздухе 3,2—9,0%.
Циклогексанон сравнительно малотоксичен, предельно допустимая концентрация паров в воздухе 0,001 мг/л. Циклогек- санон-ректификат выпускается по ВТУ МХП 3948—53.
Содержание кетона в продукте не менее 98%, воды не более 0,1%, циклогексана — следы, d420=0,944—0,948, температура кипения (при 760 мм рт. ст) в пределах 150—156° С.
Циклогексанон перевозят и хранят в герметически закрытых стальных бочках, окрашенных в серый цвет, или в бутылях с притертой пробкой. На таре должна быть надпись «Огнеопасно».
При хранении в циклогексаноне может образоваться до 1,5—2% продуктов конденсации. От продолжительного действия воздуха циклогексанон может окраситься в желтый цвет.
|
Или так же, как и циклогексанол, каталитическим гидрированием фенолов: |
|
О
|
|
СН " СН2 |
|
Или окислением циклогексана воздухом при температуре около 100° С: |
Циклогексанон хорошо растворяет жиры, масла, смолы, каучук, клей, канифоль, нитроцеллюлозу, он входит в состав пят — новыводных средств.
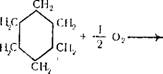
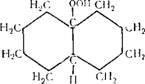
Циклогексан (гексаметилен, гексагидробензол) сЦ20 = 0,7785; мол. вес. 84,16
|
Н2С ‘
|
Сн.
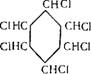
Бесцветная подвижная летучая жидкость с характерным запахом, напоминающим бензин, смешивается со спиртом, эфиром, ацетоном, бензолом, Гкип 80,74° С; Тал —6,55° С. С водой циклогексан образует азеотропную смесь (91,6% циклогексана), которая кипит при температуре 69,0° С. Циклогексан окисляется кислородом воздуха с образованием смеси циклогексанола и циклогексанона (см. стр. 30). Нитрование циклогексанона азотной кислотой (30%) приводит к образованию нитроциклогек — сана, а хлорирование — к образованию хлорциклогексана. Полное хлорирование циклогексана приводит к образованию гексахлорана (гексахлорциклогексана):
|
СН2 О Сн, |
|
|
|
I |
|
Н2с Н2с |
|
Сн2 сн2 |
|
+ 3CI, |
|
+ зн |
Циклогексан над никелем, платиной или палладием дегидрируется до бензола:
|
Сн Нс/сн HcL 11сн Сн |
|
Сн, 0Сн2 Сн2 Сн2 |
|
Н2С Н2С |
|
Ni; Pt; Pd |
При нагревании до температуры 30—80° С над хлористым или бромистым алюминием циклогексан изомеризуется в метил — циклопентан:
Сн3 I 3
|
|
|
Н2С Н2С |
|
Н, С Н2с |
|
Сн2 сн2 |
|
СН2 СН, |
|
A1CI, |
Сн
СН2
0
Сн.
Циклогексан в промышленных масштабах получают гидрированием бензола или путем ректификации из нефтепродуктов. Циклогексан огнеопасен, температура вспышки 2,5° С, пределы воспламенения в воздухе 1,33—8,35 об. %• Циклогексан токсичен, вдыхание его паров приводит к раздражению и загноению дыхательных путей. В виде жидкости циклогексан оказывает раздражающее действие на кожу. Предельно допустимая концентрация паров в воздухе 0,3 мг/л. Циклогексан выпускается по ВТУ МХП 3936—53. Удельный вес технического продукта d2020 = 0,775—0,785.
Циклогексан перевозят и хранят в стальных окрашенных, запломбированных бочках емкостью 100—250 л, имеющих надпись «Огнеопасно», гарантийный срок хранения 6 месяцев. Циклогексан хорошо растворяет жиры, масла, каучук, масляные краски, но из-за своей токсичности и огнеопасности применяется в химической чистке сравнительно редко.
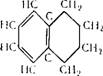
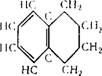
Тетралин (1,2,3,4-тетрагидронафталин) d420 = 0,9702; мол. вес. 132,20. н па
„(УЧ/^Ч:!.,
Т II I " НСЧС/ЧС/СН’
Бесцветная жидкость с запахом, напоминающим нафталин, ^кип 207,57° С; Тпл —35,8°С. Тетралин в воде не растворяется, хорошо растворяется в высших спиртах, диэтиловом (серном) и других эфирах, углеводородах, скипидаре, бензине, циклогек — саноле и др.
Как видно из формулы, тетралин имеет 2 кольца, из которых одно ароматическое, другое — алкильное, поэтому по своим химическим свойствам тетралин близок к алкилзамещенным бензола.
|
|
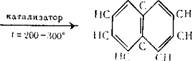
Тетралин при нагревании в присутствии катализаторов платины, никеля, палладия, окиси хрома дегидрируется (ароматизируется), переходя в нафталин.
|
|
Катализаторы готовят следующим образом, например, палладий— 10°/о-ный хлористый палладий растворяют в щелочной суспензии активного угля (норит) и затем восстанавливают его формальдегидом. Кроме указанных катализаторов могут быть использованы восстановители — сера и селен.
Как ароматический углеводород тетралин легко сульфируется и нитруется, а также хлорируется при комнатной температуре. При высоких температурах хлорируется гидрированное кольцо тетралина.
|
|
В промышленности тетралин получают путем избирательного каталитического гидрирования нафталина, очищенного от сернистых соединений. Реакция проходит на никелевых катализаторах при температуре 100—200° С или с металлическим натрием в амиловом спирте С5НцОН.
|
|
Тетралин огнебезопасен и относительно малотоксичен. Предельно допустимая концентрация паров тетралина в воздухе — 0,1 мг/л.
В присутствии воздуха, особенно при высоких температурах, тетралин окрашивается в желтый цвет.
Тетралин обладает высокой растворяющей способностью, особенно по отношению к высохшим маслам, он хорошо растворяет смолы, воски, жиры, битумы, каучук, лаки. Тетралин входит в состав различных пятновыводных средств.
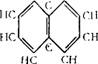
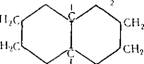
Декалин (декагидроиафталин, пергидронафталин) d420 = = 0,8865 (смесь изомеров); мол. вес 135,25.
|
|
Декалин существует в виде двух изомеров (Цис- и трансФорма).
Технический декалин содержит 60% цис- и 40% трансформы. Физические свойства приводятся для смеси изомеров.
Декалин представляет собой бесцветную легколетучую жидкость со слабым запахом камфары, Ткип 191,7°С; Тпл — 124°С.
Декалин не растворим в воде, малорастворим в уксусной кислоте и спиртах, хорошо растворим в эфире и хлороформе.
Химически декалин довольно устойчив. При каталитическом дегидрировании декалина получается нафталин (см. Тетралин). Хлорирование на свету дает 2-хлордекалин, а нитрование азотной кислотой — 9-нитродекалин.
|
П.,с |
|
СП, |
|
СП, |
|
Ч2С п сп2 |
|
|
|
НС— СООН II НС—СООН |
Окисление декалина кислородом воздуха при температуре 20—110°С дает гидроперекись:
|
Н2с ooii сн
Н2с [■] сн |
А каталитическое окисление на ванадиевом или молибденовом катализаторе при температуре 500°С приводит к образованию фталевой и малеиновой кислот, двуокиси углерода и воды:
+ 18^2 О,
+ 8 СО, + 13 Н, О
Декалин и его гомологи содержатся в нефти. В промышленности декалин получают при каталитическом гидрировании нафталина или тетралина в присутствии катализаторов — никеля,
платины или сульфида молибдена MoS3 при температуре 150 — 200° С и давлении 10—15 ат.
Декалин огнебезопасен и малотоксичен, предельно допустимая концентрация паров в воздухе не должна превышать 0,01 мг/л.
Как растворитель декалин подобен тетралину, но более летуч и обладает меньшей растворяющей способностью; его растворяющая способность приблизительно такая же, как у скипидара.
Декалин применяется для тех же целей, что и тетралин.
 19 ноября, 2012
19 ноября, 2012  admin
admin 
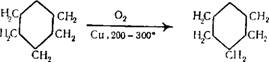
 Опубликовано в рубрике
Опубликовано в рубрике 