При полимеризации или поликонденсации, вследствие неодинаковости технологических условий, обычно получаются макромолекулы различных размеров, т. е. образуется полимергомологический ряд. Поэтому принято говорить о полидисперсности высокомолекулярного вещества, которую удобно характеризовать кривыми распределения, аналогичными тем, которые рассматривались в гл. III. На рис. XIV, 2 изображены типичные кривые распределения для одного и того же полимера. Одна кривая характеризует распределение по числу (а), другая — по массе макромолекул — (б).
|
|
|
|
А
Рис. XIV, 2. Кривые распределения фракций высокомолекулирных
Соединений:
А—по числу частиц; б—по массе частиц.
Существенная разница в форме обеих кривых объясняется тем, что малые макромолекулы, обычно присутствующие в продукте реакции в большом количестве, составляют сравнительно небольшую весовую фракцию.
Следует заметить, что набухание и растворение высокомолекулярных соединений, свойства их растворов, а также физико-механические свойства самих высокомолекулярных веществ существенным образом зависят от их полидисперсности. Поэтому определение и регулирование степени полидисперсности высокомолекулярных веществ играют в технике большую роль.
Для получения более однородных по степени полимеризации или по молекулярному весу высокомолекулярных продуктов обычно проводят их фракционирование методами растворения или осаждения.
Фракционирование растворением основано на зависимости растворимости полимергомологов от размера молекул: чем меньше молекула, тем лучше растворяется гомолог. Практически для разделения на фракции высокомолекулярное вещество обрабатывают сначала жидкостью, растворяющей низкомолекуляриые члены полимергомологического ряда, затем оставшийся продукт обрабатывают жидкостью, растворяющей уже более высокомолекулярные фракции, и т. д. Часто вместо того, чтобы пользоваться различными жидкостями для экстрагирования, применяют смеси двух жидкостей, _из которых одна служит хорошим растворителем для всех фракций, а другая является для них нерастворителем. Изменяя в смесях, которыми последовательно проводится экстрагирование, соотношение растворителя и нерастворителя, продукт можно разделить на сколь угодно большое число фракций различного молекулярного веса. Из растворов, полученных в результате фракционированного растворения, экстрагированную фракцию осаждают, прибавляя большое количество нерастворителя. Например, для фракционирования нитрата целлюлозы можно использовать смеси воды с ацетоном, для фракционирования каучука — смеси этилового спирта с бензолом.
Фракционирование осаждением проводят из раствора высокомолекулярного вещества, в котором содержатся все фракции. Приливая к этому раствору все возрастающие количества иерастворителя, в осадке последовательно получают ряд фракций. Естественно, что молекулярный вес этих фракций будет тем меньше, чем больше было прилито иерастворителя, так как наиболее низкомолекулярные фракции всегда обладают наибольшей растворимостью.
Следует отметить, что при фракционировании как растворением, так и осаждением выделение совершенно однородных фракций, в которых все молекулы имели бы одну и ту же длину, практически невозможно, поскольку с уменьшением разницы в длине цепи различие в растворимости ‘ (равно как и во всех других физических свойствах) становится весьма незначительным.
Очень часто высокомолекулярные вещества содержат примеси — электролиты, низкомолекулярные органические вещества. Для очистки высокомолекулярных веществ применяют диализ. Техника диализа растворов высокомолекулярных веществ ничем не отличается от диализа типичных коллоидных систем. Если в водном растворе очищаемого продукта присутствуют только электролиты, для удаления их с успехом можно применять электродиализ. Если продукт нерастворим в жидкости, выбранной для диализа, а способен только набухать в ней, то диализ можно заменить простым вымачиванием высокомолекулярного вещества при периодической смене жидкости.
Методы определения молекулярного веса высокомолекулярных веществ
От молекулярного веса (как и от полидисперсности) высокомолекулярных соединений зависят такие их свойства, как прочность и эластичность, способность к набуханию и растворению. Поэтому химику, имеющему дело с высокомолекулярными соединениями, важно уметь определять их молекулярный вес.
Обычные методы определения молекулярного веса органических соединений, мало пригодны для определения молекулярного веса, высокомолекулярных соединений. Поэтому разработаны совершенно новые методы определения молекулярного веса этих веществ, многие из которых близки к методам определения численного веса, применяемым в коллоидной химии. Здесь мы лишь кратко укажем принципы, на которых основаны эти методы.
Все методы определения молекулярного веса высокомолекулярных соединений могут быть разделены на четыре группы.
1. Химические методы. Если в молекуле высокомолекулярных соединений имеется известное, строго определенное число реакционноспособных групп (например, групп, расположенных на конце молекулы), то количественное определение этих групп может служить методом определения молекулярного веса. Эти методы, в связи с рядом экспериментальных трудностей, сравнительно мало применяются на практике. Они подробно рассматриваются в курсах химии высокомолекулярных веществ.
2. Термодинамические методы определения молекулярных весов основаны иа термодинамических закономерностях, характерных для разбавленных растворов, и сводятся к определению мольной доли вещества в растворе известной концентрации.
Молекулярный вес в этом случае определяют по осмотическому давлению, по понижению температуры замерзания раствора (криоскопический метод) и по повышению температуры кипения раствора полимеров (эбулиоскопический метод).
3.Молекулярно-кинетические методы основаны на перемещении макромолекул относительно растворителя и сводятся, в конечном счете, к Определению соответствующей силы трения. К этой группе методов относятся определение молекулярного веса по скорости диффузии, с помощью ультрацентрифуги и по вязкости растворов.
4. Оптический ме. то’д, получивший в последнее время широкое распространение, основан на измерении интенсивности рассеянного света растворами высокомолекулярных соединений.
Опыт показал, что из термодинамических методов единственно приемлемым является метод определения молекулярного веса по осмотическому давлению. В этом методе не приходится встречаться с теми трудностями, которые препятствуют применению этого метода для определения численного веса коллоидных систем, так как растворы высокомолекулярных соединений хорошо выдерживают очистку.
Криоскопический и эбулиоскопический методы пригодны для определения молекулярного веса полимеров с сравнительно малыми молекулами, так как в Случае очень большого молекулярного веса растворенного вещества в разбавленных растворах (к которым только и приложимы эти методы) не удается установить ощутимой разности температур замерзания и кипения.
Из молекулярно-кинетических методов определений молекулярного веса наиболее проверенным и теоретически обоснованным является метод ультрацентрифугирования.
Особого внимания заслуживает метод определения молекулярного веса по седиментационному равновесию, так как в этом случае в расчетную формулу не входит время анализа и сила трения и, следовательно, исключаются те произвольные допущения в отношении формы частиц, к которым приходится прибегать при использовании других молекулярно-кинетических методов.
Из молекулярно-кинетических методов определения молекулярного веса наиболее простым, хотя и не очень точным, является вискозиметрический метод.
Размеры молекул высокомолекулярных веществ, имеющие очень большой молекулярный вес порядка 106—107 (вирусы, гемоцианин и т. д.), можно определить и непосредственно с помощью электронной микроскопии.
Средний молекулярный вес
Выше уже указывалось, что высокомолекулярные вещества состоят из смеси молекул различного размера, но построенных по одному и тому же принципу из одних и тех же мономерных остатков. Это понятие об индивидуальном высокомолекулярном веществе существенно отличается от понятия об индивидуальном низкомолекулярном соединении, молекулы которого имеют один и тот же строго определенный размер.
Поскольку высокомолекулярное вещество всегда представляет собой смесь полимергомологов, т. е. молекул различного молекулярного веса, то приходится говорить лишь о его среднем молекулярном весе. Существенно, что это среднее значение зависит от того, какой экспериментальный метод был применен для его нахождения.
Обычно молекулярный вес полимеров выражают через так называемые числовые и весовые средние значения Мп и Мо. Среднее числовое значение молекулярного веса определяется по уравнению:
Где /if — число молекул, имеющих молекулярный вес М(. Средний числовой молекулярный вес находят с помощью всех тех методов, которые позволяют определять число молекул в исследуемом растворе высокомолекулярного вещества. Сюда относятся осмотический, криоскопический и эбулиоскопический методы.
Среднее весовое значение молекулярного веса находят по уравнению:
Ma = Z OtM, IZ at = Z ni niMi <XIV — 2)
Где G( — масса фракции с молекулярным весом М,. Средний весовой молекулярный вес определяют с помощью методов, позволяющих устанавливать средний размер молекулы в растворе. К таким мотодам относятся, например, определение молекулярного веса по скорости диффузии, седиментации в ультрацентрифуге, а также по светорассеянию. _
Совершенно очевидно, _что дл_я монодисперсного продукта Мп = Яо- Для полидисперсного вещества Мп < М0, поскольку Мо растет с увеличением полидисперсности. Очевидно также, что чем сильнее различаются молекулярные веса фракций высокомолекулярного вещества, тем больше должно быть отношение Мо/Мп. Величина Мо/Мп, характеризующая полидисперсность высокомолекулярного вещества, называется показателей, или коэффициентом, , полидисперсности.
При малом содержании в высокомолекулярном веществе иизкомолекулярной фракции значения Мп и Мв незначительно отличаются друг от друга, и отношение Мо/Мп приближается к единице. При большом содержании низкомолекулярной фракции расхождения между значениями А1П и Мс, резко возрастают и отношение Мо/Мп становится весьма большим. Ниже приводятся вычисленные значения Мп и Мо для смеси, состоящей из молекул с молекулярным весой 100 000 и 1000:
Содержание фракции с молекулярным весом
100 ООЭ, %…………………………………………………………….. 99 50
Содержание фракции с молекулярным весом 1000, % 1 50
MQ……………………………………………………………………………….. 99 000 50 500
Мп…………………………………………………………………………….. 50 030 1 980
Ма/Мп………………………………………………………………….. 1,98 £550
Определять Мп и Мв полезно и тогда, когда известно, что высокомолекулярное вещество более или менее монодисперсно. Если в этом случае наблюдается значительное расхождение между Мп и MG, то это свидетельствует о разветвленном строении молекул.
 1 ноября, 2012
1 ноября, 2012  admin
admin 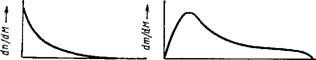
 Опубликовано в рубрике
Опубликовано в рубрике 