Закон Рауля и кажущийся молекулярный вес высокомолекулярных веществ
Как известно, идеальнее растворы, т. е. растворы, образующиеся без изменения энтальпии, энтропия которых равна энтропии смешения идеальных растворов, подчиняются закону Рауля, определяющему ряд важных свойств растворов в зависимости от содержания в них растворенного вещества. Если растворенное вещество нелетуче, т. е. если давление его паров практически равно
нулю, закон Рауля может быть выражен следующим образом:
Pi/PI — ATj — 1-М, (XIV, 19)
Где р — давление паров растворителя над раствором; р — давление паров над чистым растворителем; N і н — соответственно мольные доли растворителя н растворенного вещества в растворе.
К реальным растворам закон Рауля часто неприменим, причем наблюдаются два типа отклонений: отрицательные отклонения, когда отношение pjp° меньше мольной доли летучего компонента в растворе (т. е. pijpl < W,), и положительные отклонения, когда
Отношение pljp° больше мольной доли растворителя в растворе (т. е. p^pl > N,).
На рнс. XIV, 7 показана зависимость рі/р® от мольной доли растворенного вещества N2 для идеального раствора н для реальных растворов с отрицательным н положительным отклонением от закона Рауля.
Долгое время причину отклонения в поведении реальных растворов от закона Рауля объясняли только энергетическим взаимодействием между молекулами растворителя н растворенного вещества. Отрицательные отклонения объясняли тем, что молекулы растворителя прочнее удерживаются нелетучими молекулами растворенного вещества, чем себе подобными молекулами. Такое сильное взаимодействие указывает на сродство между растворителем н растворенным веществом, н поэтому отрицательные отклонения должны всегда наблюдаться прн хорошей совместимости обоих компонентов, а также прн сольватации нлн образовании аддитивных соединений. Понятно также, что прн отрицательных отклонениях, вызванных этнмн причинами, наблюдается контракция системы н выделение тепла. Положительные отклонения объясняли тем, что взаимодействие молекул одного рода друг с другом сильнее, чем взаимодействие молекул различной природы. Это приводит к вытеснению молекул растворителя из раствора, н следовательно, давление его пара над раствором будет выше, чем должно быть по закону Рауля. Естественно, что положительные отклонения указывают на плохую совместимость обоих компонентов. Отсюда понятно, что прн положительных отклонениях всегда происходит поглощение тепла и увеличение объема системы.
|
|
|
Рнс. XIV, 7. Зависимость Pi/?’! от для идеального раствора (/) н реальных растворов с отрицательным отклонением от закона Рауля (2) и с положительным отклонением от закона Рауля (3). |
Однако, как показали дальнейшие исследования, отклонения в поведении реальных растворов от закона Рауля могут объясняться не только энергетическим взаимодействием обоих компонентов, но н тем, что в реальных растворах энтропия смешения может быть н не равна энтропии смешения для идеальной системы. Если молекулы одного компонента могут располагаться среди молекул другого компонента большим числом способов, чем среди себе подобных молекул, то энтропия раствора будет больше значення идеальной энтропнн смешения. Понятно, что это приведет к отрицательным отклонениям от закона Рауля. Особенно важную роль подобное явление играет в случае растворов высокомолекулярных веществ, в которых молекулы растворенного вещества обладают аннзоднаметрней н гибкостью, что способствует увеличению энтропнн смешения. Наоборот, если молекулы одного компонента располагаются среди молекул другого меньшим числом способов, чем среди себе подобных, то энтропия смешения
будет меньше энтропии смешения Для идеальной системы. Такой случай наблюдается, когда растворенное вещество по тем или иным причинам лишает возможности молекулы растворителя свободно менять свои места в растворе.
Закон Рауля, связывающий давление пара растзорнтеля над раствором и концентрацию растворенного вещества, может быть использован для определения молекулярного веса растворенного вещества. Сначала опытным путем можно найтн отношение давлений паров р/р{, равное Ni. Затем, исходя нз известного уравнения, можно вычислить молекулярный вес растворенного вещества:
X——————- Mm‘lMl Ш (XIV, 20)
Где tii н П2 — соответственно число молей растворителя и растворенного вещества в идеальном растворе; mt и т2 — соответственно масса растворителя н растворенного вещества; Mt и М2 — молекулярные веса растворителя и растворенного вещества.
Поскольку для растоворов высокомолекулярных веществ значение pjp° не равно Ni, подобный метод определения молекулярного веса для них непригоден. Однако приняв, что растворы высокомолекулярных веществ ведут себя как идеальные растворы и определив Pi/P?, можно вычислить кажущийся, нлн эквивалентный, молекулярный вес высокомолекулярного вещества, т. е. величину, эквивалентную молекулярному весу вещества, которое давало бы в данном растворителе идеальный раствор.
Значение кажущегося молекулярного веса представляет собой не что иное, как молекулярный вес отрезка цепи (сегмента), являющегося в растворе кинетической единицей. Понятно, что сегмент достаточно длинных молекул не должен зависеть от молекулярного веса н что значения кажущегося молекулярного веса всегда меньше значений истинного молекулярного веса. Однако чем более разбавлены растворы, взятые для определения, тем ближе значения кажущегося молекулярного веса к значениям истинного. В пределе, при бесконечном разбавлении раствора, кажущийся молекулярный вес может стать равным истинному, так как в таком растворе кинетической единицей является уже вся макромолекула в целом. Этим можно воспользоваться для нахождения истинного молекулярного веса.
Здесь надо отметить, что длина сегмента макромолекулы в растворе определяется не только гибкостью цепи, но и ассоциацией макромолекул или их •участков. Как мы видели, ассоциация зависит как от природы растворителя, так и от природы макромолекул, т. е. от содержания в ннх полярных или ионогенных групп, по которым может устанавливаться связь. Таким образом, кажущийся молекулярный вес является величиной весьма условной, о чем никогда не следует забывать.
Поскольку в растворе мольная доли высокомолекулярных веществ, вслед — стие их огромного молекулярного веса, обычно очень невелика, то относительное понижение давлення пара растворителя даже над концентрированными растворами высокомолекулярных соединений весьма мало и экспериментально его определить крайне трудно. Поэтому на практике для нахождения молекулярного веса определяют не давление пара растворителя над раствором, а находят мольную долю растворенного вещества по осмотическому давлению, как известно, также зависящему от концентрации раствора.
1 ‘ ■ ■
Осмотическое давление it достаточно разбавленных растворов низкомолекулярных веществ подчиняется, как известно, закону Вант-Гоффа:
N = {C/M)RT (XIV, 21)
Где с — весовая концентрация; М — масса і моль; R — универсальная газовая постоянная; Т—абсолютная температура
Уравнение Вант-Гоффа по внешнему виду сходно с уравнением состояния идеального газа. Однако это сходство чисто формальное. Осмотическое давление не имеет ничего общего с давлением! газа, поэтому его нельзя представлять как результат механических ударов молекул о стенки сосуда. Осмотическое давление обусловливается тем, что растворитель переходит в раствор через мембрану до тех пор, пока этот поток растворителя не будет компенсирован направленным навстречу потоком растворителя из осмотической ячейки, возникшим вследствие повышения уровня жидкости в капилляре осмометра. Давлением со стррон«-раствора, т. е.
Гидростатическим давлением, в момент равновесия системы и измеряется осмотическое давление.
К растворам Полимеров закои Вант^Гоффа в приведенном виде неприложим. Опыт показал, что осмотическое давление растворов полимеров значительно т?ышЕ. чем это требует закон Вант-Гоффа. Объясняется это тем„ что макромолекула благодаря гибкости ведет себя в растворе как несколько более коротких молекул, т. е. что роль_ кицетческого элемента играет уже не макромолекула, а ее сегмент. Понятно, что чем более, гибка молекула, тем при прочих равных условиях осмотическое давление выше и тем больше оно отклоняется от значения, вычисленнотопЯо уравнению Вант-Гоффа. Кроме того» с повышением конденхрадщ осмотическое давление растворов по — лимеров_возрас. тает це._прямолинейно, в то время как согласна закону Влнт-Соффа осмотичргкпр пя^лрнир уарличнияртсст прям» пропорционально концентрации.
|
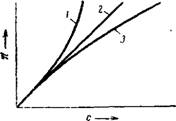
Рис. XIV, 8. Зависимость осмотического давления от концентрации раствора: 1— высокомолекулярное вещество, 2— низкомолекулярное вещество (сахар); 3—слабый электролит. |
На рис. XIV, & схематически показано изменение с повышением концентрации осмотического давления раствора низкомолекулярного вещества (сахара), слабого электролита и высокомолекулярного соединения. Как видно из рисунка, осмотическое давление раствора/низкомолекулярного вещества возрастает прямо пропорционально концентрации. В г л у ч а^/г л яУГпт адрктргушт;) когда осмотическое" давление раствора обуславливается не только числом молекул? но и ионов, осмотическое давление"возрастает более медленно, чем концентрация, о ‘чём "свидетельствует выпуклость кривой, обращенная в сторону ординаты. Такое явление объясняется — уменьшениш_степ<^^ концентрации. Наконец, осмотическое-давление растворав4лшкомодекуляр — яого вещества возрастает — быстрее, чем увеличивается концентрация. Согласно Галлеру, это объясняется тем, что при повышении
Концентрации возрастает число сегментов, на которые условно можно"разделить гибкую молекулу. На основании представлений Галлера для описания зависимости осмотического давления от концентрации полимеров было предложено уравнение:
СЯТ/М + Ьс2 (XIV, 22)
Где Ь — второй вириальный коэффициент, с — константа, характеризующая отклонение от уравнения Вант-Гоффа, зависящая от природы растворителя и растворенного вещества, но не зависящая от молекулярного веса растворенного вещества.
При малых значениях с величина второго члена правой части этого уравнения приближается к нулю и выражение принимает вид уравнения Вант-Гоффа. Уравнение (XIV, 22) можно переписать так:
Да/с = RT/M + Be (XIV, 23)
В таком виде это уравнение представляет собой уравнение прямой, по которой графически легко найти — молекулярный вес полимера. Для этого определяют осмотическое давление при разных концентрациях, "строят график в координатах nJCj С и экстраполируют прямую до пересечения с осью ординат. Отрезок, отсеченный прямой на оси ординат, равен RT/M, Я. b определится как тангенс угла, образуемого прямой и осью абсцисс.
На рис. XIV, 9 в качестве иллюстрации показана зависимость л/с от с для раствора нитрата целлюлозы в циклогексаноне и гемоглобина в воде, причем для удобства сравнения выбраны высокомолекулярные вещества с примерно одинаковым молекулярным весом <70 Q00). Как видно из рисунка, для нитрата целлюлозы (молекулы которого имеют линейное строение) значение ji/c с увеличением с возрастает, что, конечно, обусловлено увеличением числа сегментов с повышением концентрации; для гемоглобина (белка со сферическими молекулами) значение л/с, _ «естественно, не зависит от концентрации. ___
|
Рис. XIV, 9. Зависимость п/с от концентрации с растворов: /—нитрата целлюлозы в цнклогексаноие; 2—гемоглобина в воде. |
Определение молекулярного веса по_осмотическому давлению разбавленных растворов являете^, л „настоящее время одним из наиболее распространенных методов нахождения молекулярного веса.. Благодаря тому, что растворы полимеров легко очистить от яримёсей, полученные этим методом средние молекулярные веса являются гораздо более достоверными, чем численные веса, определенные тем же методом для коллоидных систем. Неточности при определении молекулярного веса осмотическим методом возможны чаще всего из-за тенденции молекул к ассоциации. Поэтому во избежание ошибок молекулярный вес высокомолекулярного веще
ства целесообразно определять путем нахождения осмотического давления его растворов в нескольких разных растворителях.
Молекулярный вес, определенный с помощью осмометрии, как мы уже указывали, дает усредненный по числу частиц, или сред — нечисденный, молекулярный вес Мп, поскольку осмотическое давление пропорционально числу молекул растворенного вещества.
На осмотическое ДавлеНие в достаточно концентрированных растворах полимеров может существенным образом влиять способ приготовления раствора. Предварительное нагревание и перемешивание способствуют повышению ос^тїїческбКг давления, а охлаждение или длительное выдерживание раствора, наоборот, понижению его. Причина этих явлений заключается в образовании ассоциатов или даже пространственных сеток макромолекул в достаточно концентрированных растворах полимеров и их разрушении при перемешивании или нагревании раствора.
Диффузия и седиментация
Вследствие большого размера макромолекул растворы высокомолекулярных веществ по своей малой диффузионной способности близки к типичным коллоидным системам. Тем не менее определение коэффициента диффузии широко используется для установления молекулярного веса высокомолекулярных соединений, например белков.
При определении молекулярного веса полимеров со сферическими молекулами диффузионным методом поступают так же, как и при нахождении этим же способом численного веса коллоидных систем. Сначала экспериментально определяют коэффициент диффузии, затем, пользуясь известным уравнением Эйнштейна, вычисляют радиус молекулы и, наконец, зная радиус молекулы и плотность растворенного вещества, находят массу 1 моля вещества.
Определение молекулярного веса нитеобразных гибких молекул диффузионным методом гораздо более сложно, так как такие молекулы диффундируют иначе, чем сферические частицы, к которым только н прнложнмо уравнение Эйнштейна в его обычном виде. Поэтому при расчетах необходимо учитывать щс называемый коэффициент днснмметрни (подробно об этрм см. первое издание этого учебника, с. 498).
Практически наиболее распространенным методом определения коэффициента диффузии высокомолекулярных веществ является метод Ламма, основанный иа фотографировании шкалы через столб жидкости, в которой происходит диффузия. Из-за различия коэффициентов преломления, обусловленных градиентом концентрации в жидкости, расстояния между делениями шкалы на фотоснимке будут иными по сравнению с подобными расстояниями на фотоснимке, снятом через чистый растворитель. Измеряя отклонение в расстояниях через определенные промежутки времени, можно получить распределение градиента концентраций по всему столбу жидкости при различной продолжительности диффузии. По этим данным можно вычислить коэффициент диффузии.
Несмотря на малый коэффициент диффузии, растворы высокомолекулярных соединений обладают, как правило, высокой седи — ментационной устойчивостью, чему значительно способствует обычно малая плотность растворенного вещества. Поэтому молекулярный вес высокомолекулярных веществ можно определить методом седиментации только с помощью достаточно мощной ультрацентрифуги.
Как н прн определении численного веса коллоидных систем, для определения молекулярного веса полимеров применяются два метода: по скорости седиментации н по седиментацнониому равновесию. Второй метод обладает тем преимуществом, что полученные с его помощью результаты не зависят от формы частнц; недостатком же его является длительность установлення седн — меитацнонного равновесия.
Интерпретация результатов, полученных этнмн методами, сильно осложняется, когда в растворе находятся не компактные частицы, а рыхлые клубки гибких молекулярных цепей. Если молекулы компактны, нх взаимодействие невелико н влияние его становится заметным лишь прн высоких концентрациях. Прн исследовании компактных структур результаты легко экстраполировать до нулевой коицентрацнн. При исследоваиин рыхлых клубкообразных структур возникают осложнения, вызываемые взаимодействием макромолекул н гидродинамикой нх оседания. В этом случае скорость седиментации так быстро изменяется с повышением концентрации, что экстраполяция может повести к существенным ошибкам.
. ^ —. — —
Цепные молекулы полимеров нельзя обнаружить в растворах при ультрамикроскопических наблюдениях. Это объясняется тем, что растворы полимеров гомогенны и линейные макромолекулы приближаются к коллоидным частицам только по длине, а в двух других направлениях соответствуют размерам обычных молекул Кроме того, линейные макромолекулы нельзя обнаружить под ультрамикроскопом из-за сольватации макромолекул (если она имеет место) и еще потому, что коэффициент преломления полимеров, как правило, сравнительно близок к коэффициенту преломления среды.
Растворы высокомолекулярных веществ способны рассеивать свет, хотя и в меньшей степени, чем типичные коллоидные системы. Дебаем предложен даже оптический метод определения молекулярного веса полимеров, основанный на измерении мутности их разбавленных растворов (величины, представляющей собой коэффициент ослабления света в результате свет9рассеяния при прохождении луча через слой раствора определенной толщины).
Светорассеяние концентрированных растворов полимеров обусловлено их неоднородностью, возникающей вследствие непрерывных небольших отклонении* концентрации, которые вызывают в свою очередь отклонения (флуктуации) показателя преломления от его среднего значення.
Согласно Эйнштейну:
32 я3 п% (dn/dcfc Не (XIV, 24)
D[Nl(RT)]/Dc д[пL(RT)]Fdc
Где т — мутность раствора; По н п — соответственно показатель преломления растворителя и раствора; дп/дс— концентрационный градиент показателя преломления раствора {величина постоянная, которая может быть заменена нэ (п — по)/с, так как в области используемых при определении концентраций разность п — п0 пропорциональна с]; к — длина волны падающего света; Д [N/(RT)]/Dc— концентрационный градиент осмотического давления; Н— постоянная величина для данной системы, равная 32я3Лд (дя/дс)2ДзЛ? дЯ,4); N а — Число Авогадро.
Обратная зависимость т от концентрационного градиента осмотического давления отвечает положению Эйнштейна, что флуктуации плотности в растворе тем больше, чем меньше осмотическое давление. ,
Уравнение (XIV, 24) можно переписать в виде:
(XIV, 25)
|
|
|
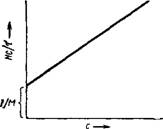
Рнс. XIV, 10. Зависимость Не/х от концентрации с Растворов высокомолекулярных соединений. |
Х ас
Осмотическое давление растворов полимеров с линейными молекулами, как мы видели выше, может быть выражено уравнением (XIV, 22):
Я = CRT/M + Be2
Где константа Ь учитывает отклонение от идеального раствора.
Подставляя уравнение (XIV, 22) в уравнение (XIV, 25), получим:
Н с __MRT)] _ Х дс
_ D[RTc/(MRT) + be*/(RT)] ^
— =±. + 2Вс ІХІV,26)
Где В = 6/(ЯГ).
Множитель В характеризует взаимодействие между молекулами растворенного вещества. При В = 0 уравнение (XIV, 26) принимает вид:
Hcjx = 1 /М
Из уравнения (XIV, 26) следует, что величина Не/Т линейно зависит от с. Такая зависимость представлена на ряс. XIV, 10. Очевидно, отрезок, отсекаемый прямой на оси ординат, численно равен величине 1 /М.
Для определения молекулярного веса по описанному методу работу ведут с растворами, содержащими около 0,1% полимера. Совершенно очевидно, что для получения правильных результатов исследуемые растворы должны быть, полностью свободны от посторонних частнц, способных рассеивать свет. Порядок работы следующий:
1) измеряют по и п для какой-нибудь одной концентрации раствора. Так как разность (л — /to) в уравнении (XIV, 24) возведена в квадрат, ее необходим» измерить с весьма высокой точностью;
2) с помощью фотометра или нефелометра измеряют т для нескольких значений с;
3) строят график в координатах Не/Т — с, находят значение Не/х пр» С-*-0, равное 1 /М, н вычисляют М. Найденное значение для полндисперсных. высокомолекулярных иеществ представляет средневесовое значение молекулярного веса Мт. ‘
Следует иметь в виду, что оптический меюд определения молекулярного веса пригоден только в том случае, если частицы меньше 0,1 длины волны рассеянного света. Это условие обычно соблюдается только для растворов полимеров, в которых макромолекулы свернуты в клубок.
Описанный метод позволяет определять также степень взаимодействия полимера с растворителем, характеризуемую отклонением системы от поведения идеального раствора
Растворы полимеров помимо светорассеяния обнаруживают способность избирательно поглощать световые лучи. По ультрафиолетовым и инфракрасным спектрам поглощения можно судить о строении полимера — наличии в его молекулах определенных атомных групп, сопряженных двойных связей и т. д. Однако поскольку эти методы применяются для исследования растворов не только полимеров, но и органических веществ вообще, мы здесь останавливаться на них не будем.
Вязкость растворов, содержащих макромолекулы, обычно выше вязкости растворов низкомолекулярных соединений и коллоидных растворов тех же концентраций. Например, у растворов каучука аномально высокая вязкость наблюдается уже при концентрациях порядка 0,05%. Только очень разбавленные растворы высокомолекулярных соединений можно считать подчиняющимися законам Ньютона и Пуазейля. Вязкость растворов высокомолекулярных веществ не подчиняется также закону Эйнштейна и возрастает с увеличением концентрации. Графически эта зависимость изображается кривой, обращенной выпуклостью к оси концентраций.
Долгое время высокую вязкость растворов высокомолекулярных соединений объясняли большой сольватацией макромолекул. Однако впоследствии, в связи с обнаружением сравнительно незначительной^ сольватации макромолекул, пришли к убеждению, что отклонения вязкости растворов высокомолекулярных соединений от законов, которым подчиняются растворы низкомолекулярных веществ, следует объяснить особенностями гидродинамики систем, содержащих вытянутые и гибкие макромолекулы и наличием в них ассоциаФов и легко разрушаемых структур.
Рассмотрим сначала сильно разбавленные растворы полимеров, в которых макромолекулы не взаимодействуют друг с другом. ІІІтаудингер, представлявший себе макромолекулы в растворе в виде жестких палочек, предложил следующую зависимость удельной вязкости т)уд от концентрации растворов полимеров:
(XIV, 27)
Тде Км —константа для каждого полимергомологического ряда; М — молекулярный вес растворенного полимера; с — концентрация раствора, выраженная в ■«основных молях» на литр. («Основной моль» — число граммов, равное молекулярному весу мономера, из которого получена молекула полимера; например, У полнбутадиена «основной» одномолярнын раствор должен содержать 54 г полимера в 1 л).
По уравнению (XIV, 27), представленному в виде:
МУд-л/(Кмс) (XIV, 28)
Можно вычислить молекулярный вес полимера, если определена удельная вязкость его раствора, известна его концентрация с и константа Км-
Значение константы Км, необходимое для определения молекулярного веса, Штаудингер находил путем измерения молекулярных весов низших членов данного полимергомологического ряда крио — скопическим методом и определения удельной вязкости их растворов. Подставляя найденные величины в уравнение:
Km-W(MC) (XIV, 29)
Штаудингер вычислял значения Км данного полимергомологического ряда.
Уравнение (XIV, 27) можно представить так:
RYJc = KMM (XIV, 30)
В таком виде уравнение указывает на линейную зависимость между величиной т)Уд/с, называемой приведенной (к единице
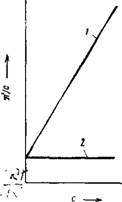
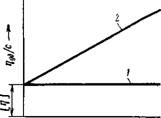
Концентрации) вязкостью, и молекулярным весом полимера. Уравнение XIV, 30 показывает также, что для одного и того же полимера (при постоянном молекулярном весе) приведенная вязкость не должна зависеть от концентрации, как это и изображено на рис. XIV, 11 (прямая /).
Первые исследования Штаудингера и С—Его сотр. как будто подтвердили пра — Рис. XIV, 11. Зависимость вильность предложенного им уравнения, приведенной вязкости от Однако дальнейшие работы показали, концентрации раствора: что приведенная вязкость растворов ОД — /— раствор, подчиняющийся НОГО И ТОГО ЖЄ ПОЛИМера ОбыЧНО ВОЗ — уравнению (XIV^);_ 2-раствор растает £ П0ВЬІШЄНИЄМ КОНЦеНТрЭЦИИ,
Причем это возрастание в интервале небольших концентраций происходит по прямой, как это показано на рис. XIV, 11 (прямая 2). Отрезок, отсекаемый этой прямой на оси т)уД/с, отвечает величине так называемой характеристической вязкости [т)], отражающей гидродинамическое сопротивление потоку молекул данного полимера. Характеристическая вязкость представляет собой приведенную вязкость при бесконечно большом разбавлении раствора.
Очевидно
М — Ит (Wc) (XIV, 31)
С-> 0
А уравнение прямой в этом случае может быть представлено как
Т, уд/с = [п] + ac (XIV, 32)
|
|
Где а — таигеис угла, образуемого прямой с осью концентраций.
Зависимость значения г)уд/с от концентрации следует отнести за счет взаимодействия макромолекул.
Далее исследования показали, что во многих случаях постоянная Км в уравнении Штаудингера зависит от молекулярного веса полимера, как правило, уменьшаясь с его увеличением. Штаудин — гер пытался объяснить это тем, что на величину Км влияет раз- ветвленность макромолекул, обычно возрастающая по мере увеличения степени полимеризации. Однако было установлено, что значение Км снижается по мере увеличения молекулярного веса и для строго линейных молекул. Хаггинс показал, что изменение Км С увеличением молекулярного веса обусловлено не увеличением разветвленности макромолекул, а тем, что более длинные молекулы способны сильнее изгибаться и тем самым оказывают относительно меньшее сопротивление потоку жидкости.
В настоящее время для определения молекулярного веса предложено уравнение, учитывающее взаимодействие макромолекул даже в разбавленных растворах и изменение константы Км. с длиной молекулы:
[г)] = kMa (XIV, 33)
Где k — коэффициент, постоянный для растворов соединений полимергомологиче — ского ряда в данном растворителе; а — величина, характеризующая форму макромолекул в растворе и связанная с гибкостью цепей.
Если а = 1, то приведенное уравнение переходит в уравнение, аналогичное уравнению Штаудингера. Если же а = О, то уравнение (XIV, 33) переходит в уравнение Эйнштейна, выведенное из предположения о сферичности частиц, согласно которому вязкость раствора не зависит от размера частиц.
На форму макромолекулы в растворе, как это показали экспериментальные исследования, существенным образом влияет природа растворителя. В одном растворителе молекулы полимеров могут быть более вытянуты, в другом — более свернуты в клубок. Как правило, чем-лучше полимер растворяется в данной жидкости, чем более он сольватирован, тем меньше участки молекулярной цепи взаимодействуют друг с другом, тем более вытянуты макромолекулы и тем выше вязкость раствора. В плохом растворителе макромолекулы мало сольватированы и поэтому образуют более компактные клубки. Поэтому введение в раствор полимера нерастворителя обычно значительно снижает вязкость раствора.
Таким образом, для одного и того же полимера, растворенного в различных растворителях, будет меняться гидродинамическое сопротивление макромолекул потоку жидкости, а следовательно, и характеристическая вязкость. Экспериментально было показано, что на зависимость г]т/с от концентрации с влияет природа растворителя, т. е. меняется наклон прямых %д/с, с. На основании некоторых соображений считают, что коэффициент, определяющий наклон прямой, пропорционален квадрату [rj]. Тогда уравнение (XIV, 32) можно написать в виде
W-fol + Afol’e (XIV, 34)
Хаггинс считает, что коэффициент ft в этом уравнении может служить характеристикой интенсивности взаимодействия молекул полимера и растворителя.
Для вычисления молекулярного веса по уравнению (XIV, 33) должны быть известны величины K и а. Эти величины вычисляют по экспериментально найденным значениям вязкости растворов и Молекулярному весу какого-нибудь члена данного полимергомоло — гического ряда, определенного другим более точным методом. В табл. XIV,4 приведены значения величин ft и а для некоторых
|
Таблица XIV, 4. Значения к и а для вискозиметрического определения молекулярных весов некоторых полимеров по уравнению {tJ=ftAfa
|
Полимеров. Для более низких молекулярных весов, чем указанные в последней колонке таблицы, значения а для всех полимеров постепенно приближаются к единице в соответствии с первоначальным уравнением Штаудингера.
Перейдем теперь к рассмотрению вязкости растворов средней концентрации. Как уже указывалось, эти растворы не подчиняются законам Ньютона и Пуазейля. Коэффициент вязкости для этих растворов не является постоянным, а зависит от градиента скорости или давления, если определение ведут с помощью капиллярного вискозиметра. При этом, так же как и для структурированных коллоидных систем, с возрастанием градиента скорости вязкость раствора падает, постепенно приближаясь к некоторому пределу.
Зависимость вязкости от градиента скорости для растворов полимеров средней концентрации обусловлена двумя причинами. Во-первых, при течении раствора длинноцепные молекулы, находящиеся в растворе в виде клубков, распрямляются и ориентируются по направлению течения, что, конечно, уменьшает гидродинамическое сопротивление потоку. Это объяснение аналогично объяснению зависимости коэффициента вязкости от градиента скорости для коллоидных систем, содержащих жесткие удлиненные частицы. Понятно, что ориентация макромолекул происходит и при течении разбавленных растворов полимеров. Однако в этом случае, вследствие малой концентрации дисперсной фазы в растворе, отклонения от закона Пуазейля проявляются значительно слабее. При течении с весьма большими градиентами скорости растяжение молекулярных цепей может быть настолько сильным, что может приводить к разрыву макромолекул. Этим, вероятно, и объясняется некоторая деполимеризация полимеров в растворах при очень большой скорости их истечения сквозь тонкие капилляры. Во-вторых, в достаточно концентрированных растворах макромолекулы могут взаимодействовать друг с другом и образовывать ассоциаты или даже обрывки пространственной сетки, сильно мешающие течению. По мере ускорения течения эти структуры постепенно разрушаются, что также должно понижать сопротивление молекул потоку, а следовательно, и вязкость растворов. Такое объяснение вполне аналогично объяснению подобного же явления для структурированных коллоидных систем.
А. А. Трапезниковым с сотр. с помощью новых методов измерения и приборов проведены многочисленные исследования реологических свойств концентрированных растворов полимеров преимущественно в неполярных растворителях. При этом определяли не только напряжение сдвига, но и обратимую деформацию и исследования проводили не только в стационарном потоке, но и в предстационарной стадии деформации. Эти исследования показали, что для многих систем можно наблюдать свойства, присущие как типичным пластическим системам, так и жидкостям, не подчиняющимся закону Ньютона и вязкость которых при истечении определяется ориентацией молекул. Для объяснения сложного комплекса свойств подобных систем необходимо отказаться от привычного представления о том, что ниже предела текучести невозможно течение. Совершенно очевидно, что если в принципе необратимая релаксация возможна при любых малых напряжениях сдвига, то и течение возможно при таких же малых напряжениях. Вопрос заключается только в продолжительности измерения и чувствительности регистрирующих приборов. В связи с этим было предложено новое понятие о пределе текучести как отражающем не появление течения, а изменение скорости течения, связанное со структурными изменениями в системе.
При повышении температуры увеличивается интенсивность движения сегментов, что препятствует образованию структур, и вследствие этого отклонение от законов Ньютона и Пуазейля при повышенных температурах наблюдается" в меньшей степени. Кроме того, при повышении температуры понижается истинный коэффициент внутреннего трения, что также обуславливает понижение вязкости раствора. Здесь, однако, уместно отметить, что повышение температуры не всегда ведет к понижению вязкости раствора высокомолекулярного вещества. Такое понижение характерно для растворов, содержащих сйльно разветвленные макромолекулы, у которых сегментарный тип движения мало выражен. Вязкость растворов, содержащих длинные неразветвленные молекулярные цепи, с повышением температуры может даже повышаться из-за увеличения интенсивности движения сегментов, преііятствующего ориентации макромолекулы в потоке.
Помимо зависимости коэффициента вязкости от градиента скорости для растворов средней концентрации наблюдаются и другие
аномалии, например увеличение вязкости при стоянии раствора, уменьшение вязкости после нагревания и последующего охлажде* ния раствора, после перемешивания и т. д. Все эти аномалии являются следствием неравновесности раствора, с которым имеет дело экспериментатор, и происходят из-за склонности системы к структурированию.
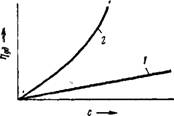
Весьма характерно изменение вязкости растворов полимеров с увеличением их концентрации. На рис. XIV, 12 показана схематически зависимость г)уд от с для водных растворов сахара и ка — зеината натрия. Как можно видеть, для раствора сахара эта зависимость выражается прямой линией. Совершенно иначе ведут себя растворы полимеров, например водный раствор казеината
Натрия. С повышением концентрации вязкость этого раствора возрастает очень резко по кривой, обращенной выпуклостью к оси концентрации. Причину такой аномалии чисто качественно можно объяснить тем, что в уравнении Эйнштейна (так же, как и в уравнении Ван-дер-Ваальса) должен фигурировать не общий объем системы, а эффективный объем, т. е. объем системы за вычетом объема макромолекул. Так как макромолекулы в растворе находятся в виде клубков, включающих большое количество растворителя, то объем этого растворителя, геометрически связанного с полимером, также следует отнести к объему дисперсной фазы (более подробно об этом см. в гл. X).
Следует заметить, что помимо указанной причины, резкое увеличение вязкости с повышением концентрации может происходить и в результате образования в системе структур. Понятно, что при этом раствор будет обладать уже структурной вязкостью, в то время как при первом объяснении концентрационной аномалии допущение о взаимодействии макромолекул не обязательно.
На вязкость так же, как и на осмотическое давление достаточно концентрированных растворов высокомолекулярных веществ, может влиять способ приготовления раствора. И здесь такое влияние объясняется медленным установлением равновесия в системе.
|
Рис. XIV, 12. Зависимость удельной вязкости от концентрации водных растворов сахара (/) и казениата натрия (2). |
Наконец, на вязкость растворов высокомолекулярных веществ может влиять введение в раствор небольших количеств некоторых веществ. Из практики, например, известно, что вязкость растворов эфиров целлюлозы при введении все возрастающих количеств спирта сначала падает, а затем возрастает. Подобные же явления наблюдаются и при введении в эти же растворы воды. При добавлении в растворы эфиров целлюлозы солей алюминия, железа, свинца, кальция, магния и цинка, как правило, вязкость повышается; при введении некоторых мыл она уменьшается.
Повышение вязкости растворов высокомолекулярных веществ при введении в них различных добавок объясняется либо увеличением взаимодействия макромолекул друг с другом в результате освобождения под влиянием примесей активных мест на молекулярных цепях, либо образованием химических связей между молекулами полимера и примесей (действие окислов металлов, альдегидов). Понижение вязкости также можно объяснить двумя причинами: либо деструкцией макромолекул под влиянием примесей (действие аммиака, альдегидов, кислот и т. д.), либо уменьшением взаимодействия цепей друг с другом в результате взаимодействия примесей с активными группами макромолекулы. v
В заключение следует отметить, что существенной особенностью растворов высокомолекулярных веществ является нелодчинение их известному правилу Вальдена. Вальден установил, что эквивалентная электропроводность X обычных вязких растворов, содержащих низкомолекулярные электролиты, обратно пропорциональна вязкости, т. е.
A, = fe(l/ti) (XIV, 35)
Или
Ал = const (XIV, 36)
В растворах высокомолекулярных веществ, вязкость которых обусловлена присутствием свернутых в клубок длинных цепных молекул, ионы низкомолекулярных электролитов способны совершенно свободно продвигаться в водной среде между этими макромолекулами. В результате электропроводность вязких растворов высокомолекулярных веществ, содержащих низкомолекулярные электролиты, практически равна электропроводности растворов этих электролитов. Отсюда понятно, почему электропроводность растворов высокомолекулярных веществ не зависит от их вязкости. Это наблюдается даже тогда, когда раствор высокомолекулярного вещества перейдет в состояние студня.
Растворы высокомолекулярных веществ, если они находятся в термодинамически равновесном состоянии, агрегативно устойчивы, как и истинные растворы. Поэтому специальные теории о устойчивости лиофильных коллоидных систем, например теория Кройта и Бунгенберг де йонга, согласно которой агрегативную устойчивость растворов желатина, агара и других высокомолекулярных соединений авторы пытались объяснить либо электрическим зарядом частиц, либо сольватацией, либо, наконец, действием обоих этих факторов одновременно, представляют теперь только исторический интерес.
При введении больших количеств электролитов наблюдается выделение высокомолекулярных веществ из раствора. Однако это явление не следует отождествлять с коагуляцией типичных коллоидных систем. Коагуляция золей происходит при введении сравнительно небольших количеств электролита и представляет собой’ обычно необратимое явление. Выделение же из раствора высоко — молекулярного вещества происходит при добавлении относительно больших количеств электролита, не подчиняется правилу Шульце— Гарди и является обычно обратимым процессом — после удаления из осадка электролита промыванием или диализом высокомолекулярное вещество снова способно к растворению.
Различен и механизм обоих явлений. Коагуляция золей происходит обычно в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда на поверхности частицы, являющегося в этом случае основным фактором устойчивости. Выделение же из раствора полимера при добавлении электролита объясняется уменьшением растворимости высокомолекулярного вещества в концентрированном растворе электролита. По аналогии с подобными явлениями в растворах низкомолекулярных веществ такое" выделение высокомолекулярного вещества из раствора можно называть высаливанием. Дебай считает, что при высаливании молекулы растворенного вещества вытесняются из электрического поля введенных ионов, которые связываются с полярными молекулами растворителя. Таким образом, высаливание принципиально не отличается от выделения высокомолекулярного вещества из раствора при добавлении к последнему нерастворителя. Как правило, высаливающее действие ионов изменяется соответственно тому порядку, в каком они стоят в лиотропном ряду. Так, катионы по мере уменьшения их высаливающего действия могут быть расположены в ряд:
Li+ > Na+ > К+ > Rb+ > Cs+ Подобный же ряд анионов имеет вид
SOf > СГ > NO" > Br" > І" > NCS"
Взаимосвязь между высаливающим действием и местом иона в лиотропном ряду вполне понятна: чем больше ион способен связывать растворитель, тем больше он будет уменьшать способность среды растворять высокомолекулярное вещество.
Высаливание лежит в основе одного из методов фракционирования высокомолекулярных веществ, поскольку способность этих соединений выделяться из раствора весьма сильно зависит от их химической природы и резко возрастает С увеличением молекулярного веса. Особенно широко применяется фракционирование с помощью высаливания для разделения белков. При этом высаливание часто сочетают с введением в систему нерастворителя (например, спирта) и охлаждением раствора. Высаливание белков целесообразно проводить при значении рН, близком к изоэлектрической точке, так как при значении рН, большем или меньшем изоэлектрической точки, возрастает заряд и гидратация белковых молекул и увеличивается их растворимость.
В растворах высокомолекулярных соединений при изменении температуры или рН или при введении низкомолекулярных веществ иногда наблюдается явление коацервации, о котором мы уже указывали. Это явление, свойственное только растворам, не находящимся в термодинамическом равновесии, заключается в разделении системы на две фазы, из которых одна представляет собой раствор высокомолекулярного вещества в растворителе, а другая — раствор растворителя в высокомолекулярном веществе. Раствор, более богатый высокомолекулярным веществом, обычно выделяется в виде мельчайших капелек. Если растворителем является полярная жидкость, например вода, мельчайшие капельки в определенных условиях могут приобретать электрический заряд, что доказывается их способностью к электрофорезу. Понятно, что электрический заряд капелек придает этим системам, вообще термодинамически неравновесным, некоторую устойчивость. Такие системы, называемые коацерватами, по существу близки к типичным эмульсиям. Высказывались предположения, что они играют важную роль в живых организмах.
Если мельчайшие капельки коацерватов не обладают достаточной агрегативной устойчивостью и в то же время не способны к коалесценции (слиянию), то они могут соединяться друг с дру — том, образуя флокулы, которые всплывают или опускаются на дно сосуда в виде рыхлого осадка. Такая флакуляция происходит обычно, когда фаза с большим содержанием высокомолекулярного компонента обладает достаточной вязкостью. Если же вязкость фазы небольшая, то происходит обычно коалесценция отдельных мельчайших капелек и постепенное образование более крупных капелек. Обычно при длительном стоянии системы, в которой произошла коацервация, образуются два гомогенных жидких ■слоя, состоящих из фаз с различным содержанием высокомолекулярного вещества. Наконец, в достаточно концентрированных растворах высокомолекулярных соединений за счет сцепления макромолекул в отдельных местах могут образовываться постоянные пространственные сетки, благодаря чему раствор превращается в студень.
В заключение необходимо хотя бы кратко остановиться на явлениях старения растворов высокомолекулярных веществ. Принято считать, что старение наглядней всего проявляется в спонтанном (самопроизвольном) изменении вязкости равновесных растворов. Ранее, когда к растворам высокомолекулярных веществ подходили с тех же позиций, что и к коллоидным системам, эти изменения вязкости объясняли медленно протекающими явлениями пептизации или, наоборот, агрегирования. В настоящее время, когда установлена гомогенность не слишком концентрированых растворов высокомолекулярных веществ, такое объяснение не может быть признано удовлетворительным.
Сейчас следует считать, что изменение вязкости растворов высокомолекулярных веществ при стоянии происходит в результате
Воздействия на молекулярные цепи присутствующего в системе кислорода или других примесей. Кислород может вызывать либо — деструкцию макромолекул, либо связывание отдельных нитевидных молекул в большие образования. В первом случае вязкость уменьшается, во втором случае — увеличивается. Аналогично на вязкость растворов высокомолекулярных соединений способны, действовать и некоторые другие примеси. Таким образом, в настоящее время можно считать установленным, что растворы высокомолекулярных соединений в отличие от типичных коллоидных систем не подвержены процессу собственно старения, а изменение некоторых их свойств при длительном стоянии обусловлено медленным действием присутствующих в них посторонних веществ.
 1 ноября, 2012
1 ноября, 2012  admin
admin 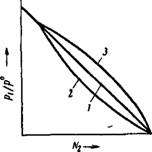
 Опубликовано в рубрике
Опубликовано в рубрике 